İstiflenme
Kimyada istiflenme, genelde aromatik olan moleküllerin atomlar arası etkileşerek deste şeklinde üst üstüste gelmesidir. İstiflenmiş bir sistemin en yaygın bilinen örneği DNA molekülünde birbirini takibeden bazlarda görülür. İstiflenme proteinlerde, non-polar iki halkanın örtüşmesi halinde de meydana gelir. Hangi moleküllerarası kuvvetlerin istiflenmeye neden olduğu hâlen tartışma konusudur.
Etkileyici kuvvetler
İstiflenmeye genelde π-π etkileşimi dense de, π-orbitalinin varlığı nedeniyle olan etkiler bu etkileşimin yalnızca bir kayanğıdır ve çoğu durumda baskın neden olmadığı gösterilmiştir.
Üçten az halkalı halka sistemlerinde, ab initio teorik hesaplamalarla gösterilmiştir ki aromatiklik istifleme kuvvetlerine az katkıda bulunmaktadır. İstiflenmiş biçimi stabilize eden bu kuvvetlerin büyüklüğü, benzer moleküllerin istiflendikleri zaman maruz oldukları van der Waals kuvvetlerinden çok farketmez. Dolayısıyla DNA nükleobazları aromatik olmalarından dolayı DNA'nın istiflenmiş yapısını stabilize etmezler; bu stabilizasyon tüm kapalı kabuklu nötür moleküllerin hissettiği intermoleküler kuvvetlerden kaynaklanır.
Supramileküler kimyada istiflenme
Supramoleküler kimyada bir aromatik etkileşim veya (π-π etkileşimi) aromatik kısımlar içeren organik bileşikler arasındaki nonkovalent etkileşimlerdir. π-konjüge systemlerde p-orbitallerin moleküller arasında örtüşmesi π-π etkileşimlerine neden olur, dolayısıyla π-elektron sayısı arttıkça etkileşimler de daha güçlü olur. Diğer nonkovalent etkileşimler arasında hidrojen bağları, van der Waals kuvvetleri, yük transfer etkileşimi ve dipol-dipol etkileşimleri sayılabilir.
π-π etkileşimleri, çok sayıda olan delokalize π-elektronları bulunmasından dolayı antrasen, trifenilen ve koronen gibi yassı polisiklik aromatik hidrokarbonlarda etkir. Diğer nonkovalent etkileşimlerden biraz daha güçlü olan bu etkileşim supramoleküler kimyanın çeşitli sahalarında önemli rol oynar. Örneğin, π-π etkileşimleri aromatik bileşiklerin kristal içindeki molekül yapılarında büyük etkisi vardır.
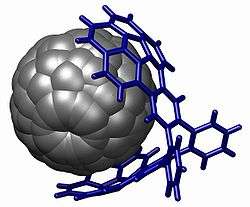
İstiflenmenin iyi bir gösterisi, aşağıda resmi görülen buckycatcher 'de bulunabilir.[2] Bu moleküler cımbız, bir fuleren molekülü ile aynı eğriliğe sahip olan iki içbükey "bucky-kâse" (İng. buckybowl )'den oluşmaktadır. Çözelti içinde, bu ikisi arasında 8600 M−1 değerinde bir birleşme katsayısı ölçülmüştür.
Biyolojide istiflenme
DNA'da komşu nükleotitler arasında pi istiflenmesi oluşur ve molekül yapısının stabilitesine katkıda bulunur. Nükleotitlerdeki bazlar pürin veya pirimidin halkalardan oluşur. DNA molekülündeki aromatik halkalar, iplikçiklere neredeyse dikey olarak yerleşmişlerdir. Dolayısıyla aromatik halkalar birbirlerine paraleldirler ve aralarında aromatik etkileşimler olabilir. Çifte bağları meydana getiren atomlardan uzanan pi bağları, komşu bağlardaki pi bağları ile örtüşürler. Kovalen olmayan bir bağ, kovalent bir bağdan daha kuvvetli olmasına rağmen, DNA molekülündeki tüm pi istiflenme etkileşimlerinin toplamı büyük bir stabilizasyon enerjisi yaratır.
Malzemelerde kullanımı
Çoğu sıvı kristal bileşikleri π-π etkileşimleri ile sütunsal yapılar oluştururlar. Ayrıca, π-π etkileşimleri nanoteknolojide kullanılan moleküler montaj tekniklerinde önemli bir unsurdur.
Aromatik istiflenme etkileşimleri
Aromatik istiflenme etkileşimleri (bunlar bazen fenil istiflenmesi olarak da adlandırılır) organik kimyada aromatik bileşikleri ve onların fonksiyonel gruplarını etkileyen bir olgudur. Yassı aromatik halkalar arasındaki kuvvetli van der Waals bağları yüzünden, farklı moleküller arasındaki bu aromatik gruplar, madenî para destesi gibi düzenlenirler. Bu bağlanma pek çok farklı polimerin özelliklerine etki eder: aramidler, polistiren, DNA, RNA, proteinler ve peptitler. Gaz sensorlarında aromatik bileşiklerin teşhisinde bu etkiden yararlanılır.
T istiflenmesi
İlgili bir etki T-istiflenmesi olarak adlandırılır, proteinlerde, bir aromatik sitemdeki pozitif yüklü bir hidrojen atomunun başka bir aromatik sistemin aromatik düzleminin ortasına doğru uzanması durumunda görülür.
Ayrica bakınız
Dış bağlantılar
Kaynakça
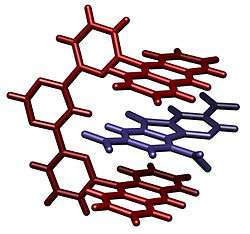
- ↑ A. Petitjean, R. G. Khoury, N. Kyritsakas and J. M. Lehn (2004). "Dynamic Devices. Shape Switching and Substrate Binding in Ion-Controlled Nanomechanical Molecular Tweezers". J. Am. Chem. Soc. 126 (21): 6637–6647. DOI:10.1021/ja031915r.
- 1 2 A. Sygula, F. R. Fronczek, R. Sygula, P. W. Rabideau and M. M. Olmstead (2007). "A Double Concave Hydrocarbon Buckycatcher". J. Am. Chem. Soc. 129 (13): 3842–3843. DOI:10.1021/ja070616p.