Eter
| Simetrik ve asimetrik Eterler | |
 |
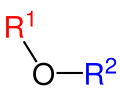 |
| Simetrik eter | Asimetrik eter |
 |
 |
| Dimetileter | Etilmetileter |
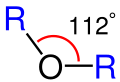
| Su ve Eterde oksijenin diğer atomlarala yaptığı açı. | |
 |
 |
| Eterde oksijenin yaptığı açı. | Su molekülünde oksijenin yaptığı açı. |
Genel itibarıyla eter denildiği zaman ilk akla gelen ağrı kesiciler olmaktadır. Yalnız eter bunun yanı sıra aynı zamanda içten yanmalı motorlarda ateşlemede kullanılmaktadır. Eterler, iki organik kısmın bir oksijen atomu üzerinden birbirine bağ yapmış organik moleküllerdir. Eterlerin genel formülü R-O-R’ şeklindedir. Buradaki R ve R’ aynı olabileceği gibi farklı organik kısımlar da olabilirler. Eterler, aynı karbon sayılı alkoller ile izomerdir. Bütün eterlerin alkol izomeri varsa da bütün alkollerin eter izomeri yoktur. Bunun nedeni de en küçük eterin iki karbonlu olmasıdır. Eterlerin izomeri olan alkollere göre kaynama noktaları daha düşüktür. Bu da molekülleri arasında hidrojen bağı bulunmamamsıdır. Eterler homolog sıra oluştururlar ve yükseltgenemezler. 2 mol mono alkolden 1 mol su çekilmesi ile simetrik eter elde edilir. Oksijenin organik kısımlarla yaptığı bağların arasındaki açı, su molekülünde hidrojenle yaptığı açıdan biraz daha büyüktür.
Adlandırma
Dallanmış ve dallanmamış Eterlerde adlandırma
| Eterlerde adlandırma yapılırken dikkat edilecek hususlar. |
 |
| 1.) Dimetileter ya da Metoksimetan |
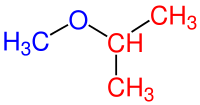 |
| 2.) 2-Metoksipropan |
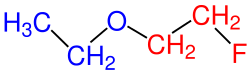 |
| 3.) 1-Etoksi-2-floretan |
Eterlerde adlandırma yapılırken kurala uygun olarak akil grupları ya da aril grupları alfabetik sıraya göre yazılır ve son olarak da ismin sonunan "eter" eki getirilir. Bu kural simetrik eterlerin adlandırılmasında ismin başına di- ekinin getirilmesiyle kolayca çüzülürken asitrik olan eterler de O-R grubunun alkoksil grubu olarak adlandırılmasında R kısmı da alkan olarak adlandırılır. Örneğin dietil eter, diğer bir değişle etoksietan, dimetil eter, yani metoksi eter şeklinde adlandırılır.
Yan taraftaki tabloya bakıldığında 1. ile gösterrilen eter molekülü simetrik bir molekül olduğundan adlandırma pek zorluk çekilmden yapılabilir. Burada oksijen atomunun her iki tarafında bulunan moleküller aynı olduğu için istenildiğinde dimetil eter şeklinde adlandırılacağı gibi metoksi metan şeklinde de adlandırılabilir.
Tablodaki 2. örneğe bakıldığında molekülün simetrik bir molekül olmadığı görülür. Böyle durumlarda oksijenin bağlı olduğu ve yapısında daha az karbon içeren kısım alkoksi grubu olarak adlandırılır. Bu örnekte maviyle gösterilen kısım alkoksi grubu ve kırmızı olarak gösterilen kısım ise alkan grubu olarak adlandırılır. Bu yüzden oksijenin solunda bir karbon bundan dolayı metoksi, oksijenin sağ tarafında ise üç karbonlu bir molekül olduğu için propan denilir. Son olarak metoksi grubu alkanın ikinci karbonuna bağlı olduğu için 2- öne yazılır ve 2-metoksipropan şeklinde adlandırılmış olur.
Tablodaki 3. örneğe bakıldığında oksijenin sağındaki ve solundaki karbon sayıları birbirine eşittir. Yalnız burada karbon ve hidrojen dışında üçüncü bir atom (F) bulunmaktadır ve bu yüzden daha fazla dallanma yapmış olarak kabul edilir. Bundan dolayı sol taraf alkan olarak ve sağ taraf da alkoki grubu olarak kabul edilir ve böyle adlandırılır.
Siklo eterlerde adlandırma
| Siklo eterlerde adlandırma | |
 |
 |
| 1. oksasikloheksan | 2. 4-floroksasikloheksan |
Siklo eterlerde adlandırma yapılırken dikkat edilecek hususları yandaki tabloda verilen örnekler üzerinden gösterilmekdedir.
Yandaki tabloda 1. ile gösterilen örneğe bakıldığında halkasal bir yapı gösterdiğini görülür. Diğer dikkat çekecek husus ise halkasal yapıyı oluşturan altı atomunun hepsinin karbon olmadığı, bunlardan birinin oksijen olduğudur. İşte halka altı atomdan oluştuğu için heksan ve bu altı atomdan birisinin oksijen olmasıyla da oksa ve halkalı olmasından dolayı da siklo eklerini alır. Sonuç olarak oksasikloheksan şeklinde adlandırma yapılır.
Tablodaki 2. örneğe bakıldığında bir önceki örneğe göre farkı yapısında flor atomunun bulunmasıdır. Burada dikkat edilecek husus ise oksijen atomunda karbon atomuymuş gibi sayılması ve bununla flor atomunun yerinin belirtilmesidir. Bu işlemi yaptıktan sonra ortaya çıkan 4-flor oksa siklo heksan, IUPAC adlandırma yöntemini gösterir.
Elde edilişleri
Alkollerin dehidrasyonu
Birincil alkoller, dehidrasyonla eter oluşturur. Dehidrasyon, alken oluşumu için uygulanan dehidrasyondan daha düşük sıcaklıklarda yapılır. Örneğin etanolün dehidrasyonuyla 140 °C'de başlıca ürün dietil eter, 180 °C'de etendir.
2 R-OH → R-O-R + H2O (simetrik eter)
Williamson sentezi
Simetrik olmyan eterlerin eldesindeki en önemli yol Williamson sentezidir. Nükleofilik bir yer değiştirme tepkimesi olan bu sentezde alkolat (alkoksit) kullanılır.
R-ONa + R'-X → R-O-R' + NaX
Alkollerin alkillenmesi
Bu tepkime kuvvetli bir asit katalizörlüğünde gerçekleşir.
R2C=CR2 + R-OH → R2CH-C(-O-R)-R2
Kimyasal özellikleri
- Eterdeki oksijen atomu, eterleri bazik yapar. Eterler, proton verici maddelerle tepkimeye girerek oksonyum tuzlarını oluşturur.
- Dialkil eterler kuvvetli asitlerle ısıtıldıklarında oksijen-karbon bağının kırıldığı tepkimeler gerçekleşir.
C2H5OC2H5 + 2HBr → 2C2H5Br + H2O
- Çok kolay tutuşurlar.
Fiziksel özelikleri
- Polar bileşiklerdir.
- Suda çözünürler, karbon sayısı arttıkça çözünürlük azalır. Dimetil eterin 100 mL sudaki çözünürlüğü 71 g iken, dietil eterin çözünürlüğü 8 gramdır.
- Alkollerle fonksiyon grup izomeridir. Alkollerde hidrojen bağı olduğu için alkollerin kaynama noktası çok daha yüksektir.
- Vernik, reçine, katı ve sıvı yağlar eterde iyi çözünür. Bu sebeple özütleme işlemlerinde sık kullanılırlar.
Kaynak
- Harold Hart (Autor), Leslie E. Craine (Autor), David J. Hart (Autor), Christopher M. Hadad (Autor); Nicole Kindler (Übersetzer): Organische Chemie, 3. Auflage, Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8, S.295-298
- T.W Graham Solamons( Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, ( Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 63