RNA polimeraz
| DNA-yönlendirmeli RNA Polimeraz | |||||||
|---|---|---|---|---|---|---|---|
| Tanımlayıcılar | |||||||
| EC numarası | 2.7.7.6 | ||||||
| CAS numarası | 9014-24-8 | ||||||
| Veritabanları | |||||||
| IntEnz | IntEnz view | ||||||
| BRENDA | BRENDA entry | ||||||
| ExPASy | NiceZyme view | ||||||
| KEGG | KEGG entry | ||||||
| MetaCyc | metabolic pathway | ||||||
| PRIAM | profile | ||||||
| PDB structures | RCSB PDB PDBe PDBsum | ||||||
| Gene Ontology | AmiGO / EGO | ||||||
| |||||||
RNA polimerazlar (kısaca RNAP veya RNApol), bir DNA veya RNA molekülündeki bilgiyi RNA molekülü olarak kopyalayan bir enzimler ailesidir. Bir gende yer alan bilginin RNA molekülü olarak kopyalanma işlemi transkripsiyon olarak adlandırılır. Hücrelerde RNAP genlerin RNA zincirleri halinde okunmasını sağlar. RNA polimeraz enzimleri, tüm canlılarda ve çoğu virüste bulunur. Kimyasal bir deyişle, RNAP, bir nükleotidil transferaz enzimidir, bir RNA molekülünün 3' ucunda ribonükleotitlerin polimerleşmesini sağlar.
RNA polimerazlar iki ana kategoride gruplandırılırlar. Bakteri, ökaryot ve arkelerde bu enzim en az beş altbirimden oluşur. Bakteriyofaj, mitokondri ve kloroplastlardaki enzim ise tek altbirimden oluşur. Her gruptaki enzimlerin ortak özellikleri o gruptakilerin evrimsel olarak ilişkili olduklarına işaret eder.
Tarihçe
RNAP, Sam Weiss ve Jerard Hurwitz tarafından, birbirlerinden bağımsız olarak, 1960'da keşfedilmiştir. Oysa, 1959 Nobel Tıp veya Fizyoloji Ödülü Severo Ochoa ve Arthur Kornberg'e RNA polimeraz zannettikleri enzimin keşfi için verilmiş, sonrasında bunun ribonükleaz olduğu ortaya çıkmıştır. Bakteriyel RNA polimerazın üç boyutlu yapısı 1999'da [1], maya RNA polimeraz II enzimininki ise 2000'de çözülmüştür.[2]
2006 Nobel Kimya ödülü Roger Kornberg'e, transkripsiyon sırasında RNA polimerazın ayrıntılı görüntülerini elde etmiş olmasından dolayı verilmiştir.
Transkripsiyon kontrolü
Gen transkripsiyonunun kontrolü gen ifadesini etki ederek hücrenin ortamına uyum sağlamasını, organizma içinde özelleşmiş işlevlerini yerine getirmesinin ve canlı kalmak için gerekli olan temel metabolik süreçleri sürdürmesini sağlar. Dolayısıyla, RNA polimerazın etkinliğinin hem karmaşık olması hem de sıkı bir sekilde düzenlenmesi gereklidir. Escherichia coli bakterisinde RNA polimeraza etki edebilen 100'den fazla faktör tanımlanmıştır.
RNA polimeraz, DNA üzerinde promotör olarak adlandırılan özel bölgelerden başlayarak transkripsiyonu başlatır. Kendisine şablon olarak kullandığı DNA zincirini tümleyici bir RNA zinciri meydana getirir. RNA zincirine nükleotidler eklenme sürecine uzama (elongasyon) denir; ökaryotlarda RNA polimeraz 2,4 milyon nükleotit uzunluğunda (distrofin geninin uzunluğu) zincirler oluşturabilir. Genin sonunda bulunan ve sonlayıcı (terminatör) olarak adlandırılan özel DNA dizgelerine gelince RNA polimeraz oluşturmuş olduğu RNA'yı salar.
RNA polimerazın ürünleri arasında aşağıdakiler bulunur:
- mesajcı RNA (mRNA)- ribozomlar tarafından protein sentezlenmesi için bir şablon işlevi görür.
- Kodlamayan RNA - Protein kodlamayan genlerin ürünleridir. Bunların en belirgin örneği taşıyıcı RNA (tRNA) ve ribozomal RNA (rRNA)'dır, bunlar protein sentezinde görev alırlar. Ancak, 1990 sonlarında pek çok yeni tür RNA geni keşfedilmiştir. RNA genlerinin hücre biyolojisinde çok daha fazla rolleri olduğu artık bilinmektedir.
- Taşıyıcı RNA (tRNA), spesifik amino asitleri protein sentezi sırasında büyümekte olan polipeptide eklenmek üzere ribozoma getirirler.
- Ribozomal RNA (rRNA), ribozomların bir parçasıdır, peptid bağların oluşmasına katalizörlük yapar.
- Mikro RNA (miRNA), gen ifadesini düzenler.
- Katalitik RNA (ribozim), katalizör özellikli RNA molekülleridir.
Transkripsiyon kofaktörleri
RNAP'ye bağlanıp onun davranışı değiştirebilen, transkripsiyon faktörü (veya kofaktörü) olarak adlandırılan çeşitli proteinler vardır. Örneğin E.coli 'de greA ve greB proteinleri, RNA polimerazın büyümekte olan RNA zincirini koparma yeteneğini artırırlar. Bu sayede, hatalı bir baz eklenmesi yüzünden duraklamış olan bir RNA polimeraz kurtarılıp yeniden çalışır hale gelir. Bir diğer kofaktör olan Mfd, transkripsiyon eşlikli tamirde görev alır, bu süreç sırasında RNAP, DNA'daki bozuklukları farkedip DNA tamiri için gerekli olan enzimleri seferber eder. Diğer kofaktörlerin düzenleyici rolleri vardır, yani RNAP'nin bir geni ifade edip etmeyeceğini belirlerler.
Çalışma mekanizmasının ana hatları
Aşağıda ana hatlarıyla verilen bakteri RNA polimerazının çalışma mekanizması genel olarak RNA polimerazların nasıl çalıştığı hakkında fikir vermek amacıyla özetlenmiştir. Diğer RNA polimerazlarda bulunan ek yardımcı proteinler bu mekanizmanın bazı ayrıntılarının farklı olmasına neden olabilir. Dolayısıyla belli bir enzim hakkında spesifik bilgi edinmek için onun maddesine bakınız.
Bağlanma ve uzama
RNA polimerazın DNA'ya bağlanması için α altbiriminin RNA başlama noktasının yukarısında, -40 ila -70 konumları arasında bir DNA dizgesini tanıması, ayrıca sigma (σ) faktörünün de -10 ile -35 arasındaki bölgeye bağlanması gerekmektedir. Gen ifadesini düzenleyen çeşitli σ faktörleri vardır, bunlar belli gen sınıfları için özelleşmişlerdir. Örneğin σ70 normal şartlarda bulunur ve hücrenin normal çalışması için gerekli genlere RNA polimerazın bağlanmasını sağlar, buna karşın σ32 ısı şokuyla ilişkili genlere bağlanmayı sağlar.
RNA polimeraz DNA'ya bağlandıktan sonra bu protein-DNA kompleksi "kapalı"dan "açık" hale dönüşür. Bu değişim sonucunda yaklaşık 13 bazlık bir bölümde DNA iplikleri birbirlerinden ayrılırlar. Ribonükleotitler şablon DNA zinciriyle baz çiftleri oluştururlar, Watson-Crick baz eşleşmeleriyle.
Yanlış nükleotidin zincire katılması durumunda RNA polimeraz geri gidip hatalı nükleotit (ve ondan bir evvelkini) çıkarıp uzatmayı yeniden dener [3]
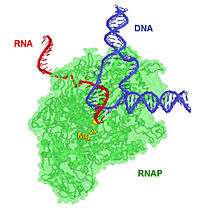
Uzama
Transkripsiyon uzaması sırasında açık kompleks bir transkripsiyon kompleksine dönüşür ve yeni ribonükleotitler eklenir. RNA transkript oluşurken polimerazın önündeki DNA daha çok açılır ve 13 çift bazlık açık kompleks 17 çift bazlık bir transkripsiyon kompleksine dönüşür. Bu aşamada promotörün -10 ile -35 arasındaki bölgesinin şekli bozulur, ve σ faktör RNA polimerazdan ayrışır. Bu sayede RNAP'nin kalan kısmı DNA üzerinde ilerleyebilir, çünkü daha evvel σ faktör polimerazı yerinde tutmaktaydı.
17 çb'lik transkripsiyon kompleksinin içinde 8 çb'lik bir DNA-RNA hibridi vardır, yani RNA transkriptinin 8 bazı DNA ipliğindeki bazlarlar eşlenmiştir. Transkripsiyon devam ettikçe RNA transkriptinin 3' ucuna ribonükleotitler eklenir ve RNAP kompleksi DNA üzerinde ilerler.
RNA'ya ribonükleotitlerin eklenme mekanziması DNA polimerizasyon mekanizmasına çok benzer, bu yüzden DNA ve RNA polimeraz enzimlerinin evrimsel olarak birbiriyle ilişkili olduğu tahmin edilir. RNAP'de aspartik asit kalıntıları Mg2+ iyonlarına bağlanırlar, bunlar da ribonükleotitlerin fosfatlarını koordine ederler. İlk Mg2+, eklenecek NTP'nin α-fosfatına bağlanır. Bu sayede RNA zincirindeki 3' OH grubundan nükleofilik bir saldırı mümkün olur ve zincire bir NTP daha eklenir. İkinci Mg2+ NTP'nin pirofosfatına bağlanır. Toplam reaksiyon denklemi şöyledir: (NMP)n + NTP --> (NMP)n+1 + PPi
Sonlanma
E. coli RNA polimerazında transkripsiyonun sonlanması rho'ya bağımlı veya rho'dan bağımsız olmak üzere iki türlü olabilir. Rho'dan bağımsız sonlanmada DNA'daki palindromik bir bölgenin okunması sonucunda oluşan RNA kendi kendisiyle baz eşlemesi yaparak firkete gibi bir şekil alır. Bu firkete yapı G-C zenginidir, DNA-RNA hibridinden daha kararlıdır. Bunun sonucundan Transkripsiyon kompleksi içinde yer alan 8 çb'lık DNA-RNA hibridi 4 bazlık bir hibride dönüşür. Bu 4 baz-çift de zayıf bağlı A-U baz çiftleridir ve bu yüzden tüm RNA transkripti polimerazdan kopar.
RNA polimeraz türleri
Bakterilerde RNA polimeraz
Bakterilerde aynı enzim hem mRNA, hem rRNA hem de tRNA'yı sentezler.
RNA polimeraz göreli olarak büyük bir moleküldür. Toplam 400 kDA büyüklüğünde olan çekirdek enzim 5 altbirimden oluşur:
- α2: İki α altbirimi enzimi bir araya getirirler ve düzenleyici faktörlerle etkileşirler. Bu altbirimlerin karboksil uç bölgesi, promotöre bağlanır, amino uç bölgesi polimerazın geri kalan kısmına bağlanır.
- β: Polimeraz etkinliğine sahiptir, zincir başlatma ve uzatma dahil, RNA sentezini katalizler.
- β': DNA'ya özgül olmayan şekilde (non-spesifik olarak) bağlanır.
- ω: RNA polimerazın altbirimlerinin bir araya gelmesini sağlar. Denatüre olmuş RNA polimerazı tekrar çalışır hale getirir, koruyucu ve şaperon işlevine sahiptir.
Promotörlere bağlanabilmek için çekirdek enzimin sigma (σ) adında bir altbirime daha gereği vardır. Sigma faktörü RNA polimerazın (non-spesifik) DNA'ya affinitesini iyice azaltıp bazı promotör bölgelere olan spesifiteyi artırır. Tüm holoenzim dolayısıyla 6 altbirimden oluşur: α2ββ'σω (~480 kDa). RNAP'nin bir kenarında, β ve β' arasında, 55 Å (5.5 nm) uzunluğunda ve 25 Å (2.5 nm) çapında bir oluk vardır, bunun içine 20 Å (2 nm) çapındaki DNA rahatça oturur. 55 Å (5.5 nm) uzunluk, 16 nükleotide karşılık gelir.
RNA polimeraz çalışmadığı zamanlar DNA üzerinde düşük affiniteli yerlere bağlı olur, yani hücre içinde serbestçe dolaşmaz.
Ökaryotlarda RNA Polimeraz
Ökaryotlarda birkaç tip RNAP vardır, bunlar farklı RNA tipleri sentezler.
- RNA polimeraz I 45S pre-rRNAyı sentezlerler, bu olgunlaşıp ribozomda yer alan 28S, 18S ve 5,8S rRNA moleküllerini oluşturur.
- RNA polimeraz II, mRNA'ların öncüllerini ve çoğu snRNA ve mikroRNA'yı sentezler. Bu polimeraz üzerinde en fazla araştırmanın yapılmış olanıdır. Pek çok transkripsiyon faktörü onun promotörlere bağlanmasına etki eder.
- RNA polimeraz III, tRNA, 5S rRNA ve diğer bazı küçük RNA'ları sentezler.
Arkelerde RNA polimeraz
Arkelerde tek bir RNAP vardır, ökaryotlardaki üç polimeraza çok benzer. Bu yüzden arke polimerazının ökaryotlardaki özelleşmiş polimerazların atasına benzediği öne sürülmüştür.
Virüslerde RNA polimeraz
Çoğu virüs kendi RNA polimearazını kodlar. En çok çalışılmış viral RNAP, bakteriofaj T7'de bulunan T7 RNA polimerazdır. Çoğu viral polimerazın DNA polimerazdan evrimleşmiş olduğu ve yukarıda tarif edilen çok alt birimli ökaryotik polimerazlarla doğrudan ilişkilerinin olmadığı düşünülmektedir. Buna rağmen RNA zincirinin oluşmasının mekanizmasını ayrıntıları temelde yukarıda anlatılan çok altbirimli RNA polimerazlarınki gibidir.
Gruplandırma
RNA polimeraz etkinliğine sahip olan çeşitli enzimler yapısal olarak iki ana grup oluştururlar.
- Birinci grup RNA polimerazlar çok altbirimli olup, bakteri RNA polimerazı, ökaryotlardaki RNA polimeraz I, II ve III'ü, arke RNA polimerazı, ve plastit DNA'sında geni bulunan kloroplast RNA polimerazını kapsar.[4]
- İkinci gruptakiler ise tek bir altbirimden oluşurlar, bu grupta SP6, T3, T7 fajlarının RNA polimerazları ve çekirdek DNA'sında geni bulunan mitokondri ve kloroplast RNA polimerazları bulunur. Birinci gruba ait olan bakteri RNA polimerazının büyüklüğü 380 kDA iken, ikinci gruptaki polimerazların büyüklüğü 100 kDA civarındadır. Bu yüzden bu RNA polimerazların ortak bir atadan evrimleşmiş oldukları muhtemel sayılmaktadır.
Burada RNA polimeraz enzimleri hakkında genel bilgiler verilmektedir, belli RNA polimerazlar hakkında daha fazla bilgi edinmek için ilgili maddelere bakınız.
Çok altbirimli RNA polimerazlar
Bakterilerdeki RNA polimeraz ile ökaryotların RNA polimeraz II'si çeşitli benzerlikler gösterirler:[5]
| bakteri RNA polimerazı | β' | β | αI | αII | ω | |
| arke RNA polimerazı | A'/A | B | D | L | K | +6 diğer |
| ökaryotik RNA polimeraz I | RPA1 | RPA2 | RPC5 | RPC9 | RPB6 | +9 diğer |
| ökaryotik RNA polimeraz II | RPB1 | RPB2 | RPB3 | RPB11 | RPB6 | +7 diğer |
| ökaryotik RNA polimeraz III | RPC1 | RPC2 | RPC5 | RPC9 | RPB6 | +11 diğer |
Bu RNA polimerazların üç boyutlu yapıları karşılaştırıldığında bir yengeç kıskacına benzerler. Kıskacın ortasında DNA için uygun boyutta yaklaşık 25 A'lık bir aralık bulunur. Enzimin aktif merkezinde bulunan Mg iyonu kıskacın tabanındadır, bakteri polimerazında β ve β' olarak adlandırılan altbirimler kıskaçları ve tabanın bir kısmını oluşturur. Birbirinin aynı olan αI ve αII altbirimleri kıskaçların dış kısımlarındadır, biri β, öbürü β' ile temas eder. ω altbirimi β' altbiriminin oluşturduğu kıskacın tabanında, DNA bağlanma aralıpından uzaktadır. Prokaryotik altbirimlerin her birinin üç boyutlu yapısı ile yukarıdaki tabloda ona karşılık gelen ökaryotik altbirimin üç boyutlu yapısı pek az bir farkla çakışır. Bu alt birimlerin birbirlerine göre olan konumları da prokaryotik ve ökaryotik enzimde ufak açı farklılıkları ile çakışır. Bu benzerliklerin yanı sıra aşağıdaki benzerlikler de vardır:
- Her iki enzimin aktif merkezi aynı yerde (kıskacı tabanında) yer alır ve içinde bir Mg2+ barındırır.
- Her iki enzimde de RNA'nın çıkması için benzer boyutlarda, konumda ve yapıda bir kanal vardır.
- Her iki enzimde de RNA'ya eklenecek nükleotidin içeri girmesi için benzer boyutlarda, konumda ve yapıda bir kanal vardır.
- Her iki enzimin de aktivasyon faktörleri tarafından etkinleştirildiği eşdeğer konumlu bir bölge vardır.
- Transkripsiyon mekanzimasında da benzerlikler vardır. Her iki polimeraz da DNA'ya bağlanınca 14 baz çiftlik bir bölgenin açılmasına neden olur. Uzayan RNA 9-11 baz uzunluğa varınca RNA polimeraz promotörden ve başlama fakt,rlerinden kopup DNA üzerinde ilerlemeye başlar.
Tek altbirimli RNA polimerazlar
Tek altbirimli RNA polimerazları DNA polimerazlarina ve ters trasnkriptaz enzimlerine benzerler. Tek altbirimli RNA polimerazların mekanizmaları faklılık gösterir. Başlama kompleksinde RNA-DNA hibiridinin uzunluğu sadece iki-üç nükleotittir, bu çok altbirimli RNA polimerazlardan oldukça farklıdır. Ancak uzama aşamasındaRNA-DNA hibridinin boyu E. coli polimerazındaki gibi 8-9 nükleotit uzunluktadır.[6]. Mitokondri RNA polimeraz, T3 ve T7 RNA polimerazdan farklı olarak, bakteriyel sigma faktörüne benzer bir yardımcı proteinle kompleksleşip sonra DNA'ya bağlanır.[7]
Tek protein birimli RNA polimerazlar DNA polimeraz ile aynı yapısal özelliklere sahip oldukları için "DNA/RNA polimerazları" adlı protein familyasında yer alırlar. Bu familyadaki diğer proteinler 1) DNA polimeraz I, 2) hata baypas DNA polimeraz katalitik bölgesi, 3) ters transkriptaz, 4) T7 RNA polimeraz, 5) RNA-bağımlı RNA polimeraz ve 6) çift iplikli RNA faj RNA-bağımlı RNA polimeraz.
Mitokondri ve kloroplastların RNA polimerazları da bu familyaya aittir.
Kaynakça
- ↑ Zhang, G. Campbell, E., Minakhin L., Richter, C., Severinov, K., & Darst, S. (1999) Crystall structure of Thermus aquaticus core RNA polymerase at 3.3 A resolution. Cell, 98, 811-824. (İngilizce)
- ↑ Cramer P, Bushnell DA, Fu J, Gnatt AL, Maier-Davis B, Thompson NE, Burgess RR, Edwards AM, David PR, Kornberg RD.(2000) Architecture of RNA polymerase II and implications for the transcription mechanism. Science. 288,640-9. (İngilizce)
- ↑ Zenkin et al., (2006) Science 28 July 2006
- ↑ Ebright, R (2000) RNA Polymerase: Structural Similarities Between Bacterial RNA Polymerase and Eukaryotic RNA Polymerase II. Journal of Molecular Biology 304, 687-698
- ↑ Ebright, R.H. (2000) Journal of Molecular Biology 304, 687-698 doi:10.1006/jmbi.2000.4309 PMID 11124018
- ↑ Jeruzalmi D. & Steitz T. (1998) Structure of T7 RNA polymerase complexed to the transcriptional inhibitor T7 lysozyme The EMBO Journal (1998) 17, 4101–4113, doi:10.1093/emboj/17.14.4101
- ↑ Mangus DA, Jang SH, Jaehning JA. Release of the yeast mitochondrial RNA polymerase specificity factor from transcription complexes. J Biol Chem. 1994 Oct 21;269(42):26568-74.