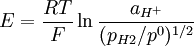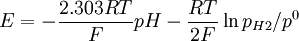Standart hidrojen elektrodu
Standart hidrojen elektrodu (SHE) (veya Normal hidrojen elektrodu (NHE)), bir redoks elektrodu olup oksidasyon-redüksiyon potansiyellerinin termodinamik ölçümlendirilmesinin temelini oluşturur. Mutlak eletrot potansiyeli 25oC de 4,44 ± 0.02 V olmasına rağmen, tüm diğer elektrot reaksiyonlarıyla karşılaştırılabilmesinde temel olması açısından, hidrojenin standart elektrot potansiyel değeri (E0) tüm sıcaklıklarda sıfır olarak kabul edilmiştir.[1]. Herhangi bir elektrodun potansiyeli, standart hidrojen elektrodunun aynı sıcaklıktaki potansiyeli ile karşılaştırılır.
Hidrojen elektrodunun temelindeki yarı hücre reaksiyonu:
- 2H+ + 2e– → H2(g)
şeklindedir.
Bu redoks reaksiyonu platin kaplı platin elektrot yüzeyinde gerçekleşir. Platin elektrot kulanmanın nedenleri arasında;
- çok büyük yüzey alanına sahip elektrot kullanma zorunluluğu (elektrot alanı ne kadar büyükse, elektrot kinetiği o kadar hızlıdır),
- hidrojeni kendi arayüzeyinde adsorblayacak bir elektrot malzemesi kullanma zorunluluğu (bu faktör de elektrot kinetiğini hızlandırır)
sayılabilir.
Nernst denklemi:
veya
şeklinde yazılabilir, ki burada:
- aH+ hidrojen iyonu aktivitesi, aH+=fH+ CH+ /C0
- pH2 hidrojenin kısmi basıncı (pascal, Pa)
- R gaz sabiti
- T sıcaklık (kelvin)
- F Faraday sabiti (mol elektronun yükü, 9.6485309*104 C mol−1 e eşittir)
- p0 standart basınç (105 Pa)
Etkileşim
Platin kaplı platin elektrodun yüksek adsorbsiyon aktivitesi nedeniyle elektrot yüzeyinin ve çözeltinin, organik maddelerden ve havadaki oksijenden korunması büyük önem arzeder.
Yapısı
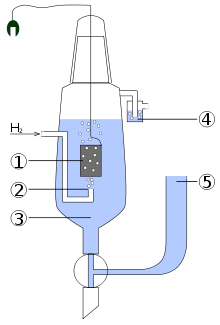
Standart hidrojen elektrodunun şematik yapısı yanda görüldüğü gibidir:
- platin kaplı platin elektrot
- hidrojen üfleme
- aktivitesi H+ = 1 mol dm−3 olan asidik çözelti
- oksijenle teması önleyen su tuzağı
- ikinci yarı hücrenin birleştirileceği rezervuar, ki bu, üzerinde çalışılan elektroda iyonik olarak iletken bir yol yaratır.