Üre
| Üre | |
|---|---|
 | |
 |
 |
 | |
| Amino metanamid | |
| Diğer adlar Karbamid, karbonil diamid, karbonildiamin, diaminometanal, diaminometanon | |
| Tanımlayıcılar | |
| CAS numarası | 57-13-6 |
| PubChem | 1176 |
| DrugBank | DB03904 |
| KEGG | D00023 |
| ChEBI | 16199 |
| RTECS numarası | YR6250000 |
| ATC kodu | B05,Şablon:ATC |
| SMILES |
|
| InChI |
|
| ChemSpider | 1143 |
| Özellikler | |
| Kimyasal formül | CH4N2O |
| Molar kütle | 60,06 g mol−1 |
| Görünüm | Beyaz katı |
| Yoğunluk | 1.32 gr/cm3 |
| Erime noktası |
133 – 135 °C |
| Çözünürlük (su içinde) | 107.9 gr/100 ml (20 °C) 167 gr/100ml (40 °C) 251 gr/100 ml (60 °C) 400 gr/100 ml (80 °C) |
| Çözünürlük () | 500 gr/L gliserin,[1] 50 gr/L etanol |
| Baziklik (pKb) | pKBH+ = 0.18[2] |
| Tehlikeler | |
| Parlama noktası | Yanıcı değildir |
| LD50 | 8500 mg/kg (oral, sıçan) |
| Belirtilmiş yerler dışında verilmiş olan veriler, standart haldedir. (25 °C, 100 kPa) | |
| Bilgikutusu kaynakları | |
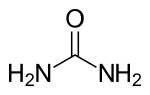
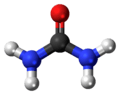
Üre (Latince Urea Pura), organik bir bileşik. Formülü H2N-CO-NH2'dir. Karbonik asidin diamidi olan üre aynı zamanda karbamik asidin de amidi olduğundan karbamid adı ile de bilinir.
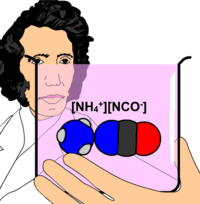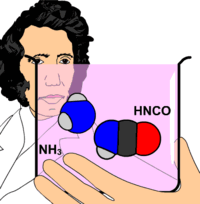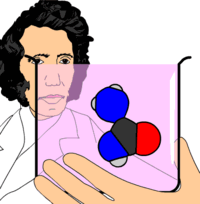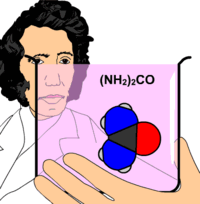
Ürenin ilk defa 1773 yılında keşfedildiği bilinir. Ancak şüpheden uzak kesin sentezi 1828'de Wöhler tarafından başarılmıştır. Keşfinden bu yana 50'den fazla tepkimede üre bir ürün olarak elde edilmiştir.
Amonyum karbonatın 150-200 °C'ye kadar ısıtılmasından üre elde edilir ki bu teknik bir metoddur. Wöhler sentezi olarak bilinen reaksiyonda ise; önce KCN ile PbO2 karışımı ısıtılarak KCNO elde edilir. KCNO nun amonyum sülfat ile muamelesi sonucu hazırlanan amonyum siyanatın kızdırılmasıyla da üre elde edilir. Üre 132 °C'de eriyen rombik prizmalar veya iğne şeklinde renksiz kristaller verir. Su ve alkolde iyi çözünür. Kloroform, eter veya etil asetatta çözünmez. 132 °C'nin üstünde amonyak, siyanür asidi vb. gibi ürünler vererek bozunur. Nitrik asit, sodyum hipoklorit veya sodyum hipobromit gibi bileşiklerin etkisiyle azot, su ve karbondiokside ayrışır. Seyreltik asit veya alkalilerle ısıtıldığında amonyak ve karbondioksite bozunur.
En çok gübre ve hayvan yemi olarak kullanılan üreden ilaç ve plastik yapımında da faydalanılır. Üre asit ve tuzlarla bir takım katılma bileşikleri, bazı asitlerle de kondensasyon ürünleri veya üreidleri verir. Naftalinin türevleriyle verdiği bileşikleri terapide kullanılır. Boya üretiminde de kullanılan üre aynı zamanda bitkiler için bir besin kaynağıdır. Nitrik asitle gübre ve patlayıcı madde olarak kullanılan üre nitrat adı verilen bir tuz oluşturur.
Fizyolojik önemi
Üre, fizyolojik önemi bulunan bir bileşiktir. Memelilerin vücudunda protein maddelerinin yakılması sonucu meydana gelen amonyak, karaciğerde karbondioksitle üreye dönüşür. Kana geçen üre, idrarla dışarıya atılır. Üre ayrıca az miktarda ter, süt ve gözyaşında da bulunur. Yetişkin bir insan günde 25-30 gram üreyi idrarla atar. İnsan kanındaki üre miktarı normalde % 50 mg civarındadır. % 50 mg'ın üstü anormaldir. Fakat vücut yaşlandıkça, böbreklerin üreyi vücuttan atma kabiliyeti de her geçen yıl bir parça daha azalacaktır. 40 yaşından itibaren, her yıl böbreklerin süzme kabiliyeti % 1 oranında azalmaktadır. Bu yüzden 75-80 yaşındaki bir kişide kandaki üre miktarının % 65–75 mg bulunmasını normal olarak kabul etmek gerekir. Kandaki üre miktarının beklenen normal değerin üzerinde olması haline üremi adı verilir.
Ayrıca bakınız
- Wöhler üre sentezi
Notlar
[3] }}
Kaynakça
- ↑ "Solubility of Various Compounds in Glycerine". 13 Nisan 2014 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20140413155224/http://msdssearch.dow.com/PublishedLiteratureDOWCOM/dh_0032/0901b8038003228b.pdf?filepath=glycerine/pdfs/noreg/115-00668.pdf.
- ↑ Williams, R. (2001-10-24). "pKa Data". 18 Şubat 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150218163011/http://research.chem.psu.edu:80/brpgroup/pKa_compilation.pdf. Erişim tarihi: 2009-11-27.
- ↑ Wöhler'in "Amonyum siyanat üredir" açıklaması yanlıştır. Bunlar iki farklı kimyasal madde olup standart koşullar altında ağırlıklı olarak üre lehine olan bir kimyasal denge içerisindedirler.[4]
- ↑ J. Shorter (1978). "The conversion of ammonium cyanate into urea—a saga in reaction mechanisms". Chemical Society Reviews (Royal Society of Chemistry) 7 (1): 1–14. DOI:10.1039/CS9780700001. http://pubs.rsc.org/en/Content/ArticleLanding/1978/CS/cs9780700001#!divAbstract.
