Su
| Su | |
|---|---|
 | |
 | |
 | |
 | |
| Su, oxidan | |
| Diğer adlar Hidrojen oksit, Dihidrojen monoksit (DHMO), Hidrojen monoksit, Dihidrojen oksit, Hidrojen hidroksit (HH veya HOH), Hidrik asit, Hidrohidroksik asit, Hidroksik asit, Hidrol,[1] μ-Oksido dihidrojen | |
| Tanımlayıcılar | |
| CAS numarası | 7732-18-5 |
| PubChem | 962 |
| ChEBI | 15377 |
| RTECS numarası | ZC0110000 |
| SMILES |
|
| ChemSpider | 937 |
| Özellikler | |
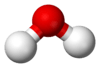
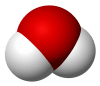
| Kimyasal formül | H2O |
| Molar kütle | 18,02 g mol−1 |
| Görünüm | Beyaz katı veya biraz mavi iziyle neredeyse renksiz, şeffaf, kristalli katı veya sıvı.[2] |
| Koku | Kokusuz |
| Yoğunluk | 999,9720 kg/m3 ≈ 1 t/m3 = 1 kg/l = 1 g/cm3 ≈ 62,4 lb/ft3 (sıvı, maksimum, ~4 °C) 917 kg/m3 (katı) |
| Erime noktası |
0,00 °C (32,00 °F; 273,155 K) |
| Kaynama noktası |
100 °C (212 °F; 373,155 K) |
| Çözünürlük () | Haloalkanlar, alifatik ve aromatik hidrokarbonlar, ve eterlerde az çözünür.[3] Metanol, etanol, izopropanol, aseton ve gliserol ile karışabilir. |
| Asitlik (pKa) | 15,74 ( ~35–36 °C) 14,0 (25°C)[4] |
| Baziklik (pKb) | 15,74 |
| Tehlikeler | |
| NFPA 704 |
 0
0
0
|
| Parlama noktası | Yanıcı değildir. |
| Belirtilmiş yerler dışında verilmiş olan veriler, standart haldedir. (25 °C, 100 kPa) | |
| Bilgikutusu kaynakları | |
Su; Dünya'da bol miktarda bulunan ve hayat için vazgeçilmez olan, kokusuz ve tatsız bir bileşik.[5] Sıklıkla renksiz olarak tanımlanmasına rağmen kızıl dalga boylarında ışığı hafifçe emmesi nedeniyle tabii bir mavi renge sahiptir.[5]
Doğada su katı, sıvı ve gaz hâllerinde görülür.[5] Kimyasal formülü (H2O) 2 hidrojen ve 1 oksijen atomundan meydana gelir. H+ iyonu içeren bir madde ile (ör. asit) ve OH- iyonu içeren maddenin (ör: baz) verdiği nörtalleşme tepkimesi ile oluşur.
Bilim insanları Dünya'daki hayatın suda başladığını düşünmektedir.[5] Su moleküler yapısı oldukça basit ve bol bulunan bir madde olmasına rağmen belirli koşullarda diğer bileşiklerden oldukça farklı davranışlar sergiler.Örneğin katı (buz) hâldeki su sıvı hâldeki suyun üzerinde yüzer. Dünyadaki hemen hemen tüm diğer bileşiklerde ise katı faz sıvı fazdan yoğundur ve katı fazdaki bileşik batar.[5] Suyun bu özelliğin bazı avantajları vardır. Örneğin soğuk bir bölgede göl yüzeyini kaplayan buz tabakası yalıtıcı görevi görür ve dipteki hayatı korur. Buzun çökmesi durumunda canlılar şiddetli soğuğa maruz kalacağından hayatlarını devam ettirmeleri imkansız hâle gelecektir.[5]
Su yanıcı bir madde değildir. Bu özelliği nedeniyle ateş söndürücü olarak kullanılır. Fakat suyun bileşimindeki Oksijen yakıcı bir gazdır, Hidrojen ise yanıcı bir gazdır. Oksijen ve hidrojen birleşerek söndürücü olan suyu oluşturur.
H2O saf suyu temsil eder, saf suya tabii en yakın örnek yağmur suyudur. Saf su canlılar için içilebilir su değildir, insanlara yararı yoktur. Suyun akışkan olması dışında insanlar ve canlılar için içinde taşıdığı mineraller çok önemlidir. Canlıların içmesi gereken suda mineral olması gerekmektedir. Yağmur suyu yani saf su, yağdıktan sonra toprağa düşünce toprağın yapısındaki mineralleri toplar, yeryüzünde bu yağmur suları bir akarsu oluşturur bu içilebilir bir sudur. Genelde toprak altındaki suları kirleten bina yapılaşmaları, sanayiden, insan hayat alanından vs uzak sağlığa uygun olması için çok yüksek yerlerde, dağlardaki akarsu ya da tabii su kaynağı bulunup buralara su doldurma tesisi yapılır, bu tabii mineralli sular şişelenip marketlerde "tabii kaynak suyu" olarak satılır. Her bölgedeki toprakta mineraller ve oranları farklıdır, bu yüzden suyun faydaları bölgelere göre değişebilir.
Kohezyon ve adezyon
Su, kendi molekülleri arasındaki çekim kuvveti (kohezyon) sayesinde dağılmadan kalabilir. Moleküllerinin dipol (kutuplaşmış) olması nedeniyle su, birçok maddeye yapışabilir ve ıslatma özelliği buradan gelir.
Su aynı zamanda adezyon (farklı iki maddenin molekülleri arasındaki çekim kuvveti) kuvveti yüksek bir maddedir. Hidrojen bağı nedeniyle su molekülleri birbirlerini de çekerler yani su molekülleri arasında kohezyon gücü de çok yüksektir. Suyun kohezyon ve adhezyon yetenekleri, suyun belirli kılcal yapılar içinde kopmadan yükselmesine ve taşınmasına yardımcı olur. Bu da bitkilerin karada hayatlarını sürdürmeleri açısından önem arz eder. Örneğin; civanın dağılmamasıdır.
Suyun sekliğini sağlayan kohezyon maddesi, adezyon kuvveti ile çarpışarak suyu daha sek hâle getirir. Molekülleri sekleşen su, artık daha yumuşak ve saftır. Suyun rengini ve tadını sekliği belirler.
Yüzey gerilimi
Su, molekülleri arasındaki güçlü kohezyon kuvveti nedeniyle oluşan yüksek yüzey gerilimine sahiptir. Bu görülebilir bir etkidir, örneğin, küçük miktardaki su çözünemez bir yüzey üzerine (örn: polietilen) konduğunda, su, diğer madde ile beraber düşene dek kalacaktır.
Bu kuvvetin kaynağı temel olarak su moleküllerini bir arada tutan moleküller arası çekici kuvvetlerdir. Suyun içinde olan moleküller her yönden komşu moleküllerle kuşatıldıkları için, üzerlerine etkiyen toplam kuvvet sıfırdır. Buna karşın, yüzeydeki moleküllerin sadece bir tarafı diğer su molekülleriyle çevrili olduğu için, bunlar içeriye doğru net bir kuvvetle çekilirler. Bu durum yüzeyde bir gerilme oluşturup yüzeyin minimum olmasını sağlar. Hacimleri eşit birçok geometrik şekil içinde yüzey alanı en az olan küredir. Su damlalarının küresel bir şekil alması da yüzey geriliminin en az yüzey oluşturacak şekilde molekülleri hareket ettirmesidir.
Kılcal hareket
Kılcal hareket, suyun çok dar (kılcal) bir boru/kanalda yerçekimi kuvvetine karşı hareketini ifade eder. Bu hareket oluşur, çünkü su boru/kanalın yüzeyine yapışır ve daha sonra boru/kanala yapışan su, kohezyon kuvveti sayesinde üzerinden daha fazla suyun geçmesini sağlar. İşlem, yerçekimi adhezyon kuvvetini yenecek kadar su boru/kanaldan yukarı geçinceye dek tekrarlanır. Bu olayı doğada da görmek mümkündür. Örneğin ağaçların kılcal damarlarında su en yüksek dallara kadar yerçekimine karşı hareket edebilmektedir.Buna aynı zamanda kapiler etki denmektedir.
Erime
1 gram buzu eritmek için 0 °C'de 80 kalori gerekir. Erime ısısının yüksek olması suyun donmasını geciktirir; böylece biyolojik sistemler düşük sıcaklıklara dayanıklı olabilen özelliklerini kazanırlar.
Özgül ısı
Suyun Isınma (özgül) ısısı yüksektir. 1 gr suyun sıcaklığını 1 °C arttırmak için 1 kalori'lik enerji gereklidir. Bu özgül ısı, amonyak dışındaki tüm maddelerinkinden yüksektir. Böylece su sıcaklıklarda fazla artış olmadan daha fazla enerji depolayabilir ve böylece canlı sistemde sıcaklık ve metabolik olaylar daha kararlı olabilmektedir.
Buharlaşma
Suyun gizli buharlaşma ısısı yüksektir. 100 °C'de 1 g suyu 1 g su buharı hâline dönüştürmek için 539 kaloriye ihtiyaç vardır. Gizli buharlaşma ısısının yüksekliği canlı sisteminin izotermal olmasında en önemli katkıya sahiptir. Suyun gizli buharlaşma ısısı, H bağlarından dolayı yüksektir.
Donma
Suyun basit fakat çevre açısından son derece önemli bir özelliği de suyun sıvı hâli üzerinde batmadan yüzebilen, suyun katı hâli olan buzdur. Bu katı faz, (sadece düşük sıcaklıklarda oluşabilen) hidrojen bağları arasındaki geometriden dolayı, sıvı hâldeki su kadar yoğun değildir. Hemen hemen tüm diğer maddeler için, katı form sıvı formdan daha yoğundur. Standart atmosferik basınçtaki taze su, en yoğun hâlini 3,98 °C'de alır ve aşağı hareket eder, daha fazla soğuması hâlinde yoğunluğu azalır ve yukarı doğru yükselir. Bu dönüşüm, derindeki suyun, derinde olmayan sudan daha sıcak kalmasına sebep olur, bu yüzden suyun büyük miktardaki alt bölümü 4 °C civarında sabit kalırken, buz öncelikle yüzeyde oluşmaya başlar ve daha sonra aşağı yayılır. Bu etkiden dolayı, göllerin yüzeyi buz ile kaplanır. Hemen hemen tüm diğer kimyasal maddelerin katı hâlleri, sıvı hâline göre yoğun olduğundan dipten yukarı donmaya başlarlar.
Suyun hacmi, bilinen tüm sıvıların aksine, belirli bir sıcaklığa (+4 °C'ye) düşene kadar azalır, daha sonra tekrar artmaya başlar. Donduğunda ise hacmi sıvı hâle göre daha fazladır. Bu nedenle suyun katı hâli, sıvı hâlinden daha hafiftir. Bu yüzden buz, suyun dibine batmayıp su üstünde yüzer. Suyun bu özelliği hayatın kış aylarında ya da her zaman soğuk olan bölgelerde sudaki hayatın devam etmesine olanak tanır. Deniz, nehir ve göllerin üst kısmı donar, buz üst kısımda kaldığı için su içindeki canlılar hayatlarını sürdürmeye devam edebilirler.
100% saf su -48 °C'de donar[6]

Üçlü noktası
Suyun üçlü noktası (saf hâldeki sıvı su, buz ve su buharının dengede bulunduğu sıcaklık ve basınç kombinasyonu), kelvin sıcaklık ölçü biriminin tanımlanması için kullanılır. Sonuç olarak, suyun üçlü nokta sıcaklığı, 273,16 Kelvin (0,01 °C) ve basıncı 611,73 Pascal'dır (0,0060373 ATM).
Elektriksel iletkenlik
Genellikle yanlış bir kanı olarak, suyun çok güçlü bir elektrik iletken olduğu düşünülür ve elektrik akımının öldürücü etkilerini iletme riski bu popüler inanış ile açıklanır. Su içindeki tüm elektriksel özelliği sağlayan etkenler, suyun içinde çözülmüş olan karbondioksit ve mineral tuzların iyonlarıdır. Su, iki su molekülünün bir hidroksit anyonu ve bir hidronyum katyonu hâlini alması ile kendini iyonize eder, fakat bu elektrik akımının yaptığı iş veya zararlı etkilerini taşımak için yeterli değildir. ("Saf" su içinde, hassas ölçüm cihazları, 0,055 µS gibi çok zayıf bir elektriksel iletkenlik değeri saptayabilirler.) Saf su, oksijen ve hidrojen gazları içinde de çözülmüş iyonlar olmadan elektroliz olabilir; bu çok yavaş bir süreçtir ve bu şekilde çok küçük bir akım iletilir. (Elektroliz, elektrik akımı yardımıyla, bir sıvı içinde çözünmüş kimyasal bileşiklerin ayrıştırılması işlemine denir.)
Suyun hâlleri
Su yerkürede değişik hâllerde bulunur: su buharı, (bulutlar), su (denizler, göller), buz (kar, dolu, buzullar) gibi. Su sürekli olarak su döngüsü olarak bilinen döngü içinde değişik fiziksel hâllere dönüşür.

Yağışın insanlık ve tarım için öneminden dolayı, değişik biçimlerine farklı isimler verilmiştir: çoğu ülkede genel ismi yağmur'dur, dolu, kar, sis ve çiy diğer örneklerdir. Uygun şartlar oluştuğunda, havadaki su damlacıkları güneş ışığını kırarak, gökkuşağı oluştururlar.
Temel olarak, su akışı, nehirler ve tarım için su ihtiyacı gibi, insanlık tarihinde büyük roller oynamıştır. Nehirler ve denizler, ticaret ve ulaşım için elverişli yollar sunmuştur. Su akışı, erozyon etkisi ile çevrenin şekillenmesinde büyük roller oynayarak, vadiler ve deltalar oluşmasını sağlamış ve insanların yerleşimine uygun arazi ve alanlar meydana getirmiştir.
Su aynı zamanda zemine nüfuz ederek, yer altına doğru iner. Bu yeraltı suları daha sonra tekrar yüzeye çıkarak tabii kaynaklar, sıcak su kaynakları ve gayzerler oluşturur. Yeraltı suları, aynı zamanda ambalajlanarak maden suyu olarak satılmaktadır.
Su, kendi içinde farklı maddelerin koku ve tatlarını barındırabilir. Bu nedenle, insan ve hayvanların, suyun içilebilirliğini anlamak için duyuları gelişmiştir. Hayvanlar genel olarak, tuzlu deniz suyunun ve bataklık suyunun tadından hoşlanmaz, dağlardan veya yeraltından gelen saf kaynak sularını ararlar. Kaynak suyu veya mineral su diye bilinen tat, aslında suyun içinde çözülmüş olan minerallerin tadıdır. Saf su (H2O), tatsızdır. Bu yüzden, kaynak veya mineral suyunun saflığı diye bilinen şey, suyun içinde zararlı (toksik) maddeler, kir, toz veya mikrobik organizmalar olmadığını belirtir.
İnsan hayatındaki yeri
Yetişkin bir insan vücut ağırlığının %60-70'i (2/3'si) sudur. Bu oran yaşa, cinsiyete, kiloya bağlı olarak farklılık gösterir. Örneğin yeni doğan bebeklerin vücudundaki su oranı %75'dir. Hayatın ilk 5 gününde %70'e inen su oranı, sonradan yavaş yavaş azalarak bir yaşın sonunda yetişkindeki su oranına yaklaşır. Erkeklerdeki su oranı kadınlara, şişmanlar zayıflara oranla daha fazladır. Yaş ilerledikçe de vücut suyunda azalma görülür.
Su besinler ve içeceklerle de sindirim yoluyla vücuda alınır. Vücuda alınan su sindirim sisteminde emildikten sonra kana geçer. Kan dolaşımı ile vücuda dağılır ve kılcal damarlardan çıkarak doku sıvısını oluşturur. Hücre içinde bazı kimyasal reaksiyonlara katıldıktan sonra tekrar hücre dışına çıkar ve tekrar doku sıvısına dönüşür. Dokulardan kan dolaşımına katılır. Kan dolaşımı aracılığı ile böbreklere gelerek önemli bir kısmı idrar olarak vücut dışına atılır. Diğer bir kısmı ise deri, solunum ve sindirim sistemi vasıtasıyla kullanılıp vücuttan atılır.
Yetişkin bir insanın günlük su ihtiyacı 2500-2600 ml kadardır. Suyun vücuda alımı ve atılımı bir denge içinde oluşur. Vücutta normal sıvı hacminin korunması için günlük sıvı alımının günlük sıvı kaybına eşit olması gerekir. Bu denge bozulduğunda hastalıklar ortaya çıkar. Yemek yemeden aylarca yaşanabilir, ancak susuz sadece birkaç gün dayanılabilir. İnsan vücudunda su dengesini düzenleyen (regüle eden) merkezler ve sistemler mevcuttur.
- Vücuda su alımı (Hidrasyon) : Vücuda besinlerle (1000nbsp;ml) ve içeceklerle (1200nbsp;ml) ağız yoluyla su alımına ekzojen su kazanımı denir. Bir de vücudumuzda hücre metabolizması esnasında meydana gelen kimyasal reaksiyonlar sonucu oksidasyon ürünü olarak 300nbsp;ml kadar su açığa çıkar. Vücutta bu şekilde su açığa çıkmasına endojen su kazanımı denir.
- Vücuttan su kaybı (Dehidrasyon) : Vücuda alınan su, idrarla böbreklerden (1500nbsp;ml kadarı), solunum havasıyla akciğerlerden (500 ml kadarı), terleme yolu ile deriden (500nbsp;ml kadarı) ve gaita ile bağırsaklardan (100nbsp;ml kadarı) vücut dışına atılır.
- %1: Susuzluk hissi, ısı düzeninin bozulması, performans azalması,
- %3: Vücut ısı düzenin iyice bozulması, aşırı susuzluk hissi,
- %4: Fiziksel performansın %20-30 düşmesi,
- %5: Baş ağrısı, yorgunluk,
- %6: Hâlsizlik, titreme,
- %7: Fiziksel faaliyet sürerse bayılma,
- %10: Bilinç kaybı,
- %11: Vücut dirençsizliği, olası ölüm,
- %12: %97 oranında ölüm,
- %15: %100 ölüm.
Suyun vücuttaki görevleri
- Hücrelerin ihtiyacı olan maddeleri hücreye taşımak,
- Hücrelerin fonksiyonlarını yerine getirebilmesi için gerekli olan katı maddelerin çözünmesini sağlamak,
- Hücrelerde metabolik faaliyetler sonucu oluşan atık maddeleri boşaltım organlarına (böbrek, akciğer, deri, sindirim kanalı) taşıyarak vücut dışına atılımını sağlamak,
- Vücut ısısını dengede tutmak,
- Kanın hacmini dengelemek,
- Besinlerin sindirimine yardımcı olmak,
- Beyin, omurilik gibi bazı organları dış etkenlerden korumak, suyun görevleridir.
Kaynaklar
- ↑ "Definition of Hydrol". Merriam-Webster. 4 Mart 2016 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20160304033134/http://www.merriam-webster.com/dictionary/hydrol.
- ↑
- ↑ http://chemister.ru/Database/properties-en.php?dbid=1&id=1
- ↑ http://chemwiki.ucdavis.edu/Core/Organic_Chemistry/Fundamentals/What_is_the_pKa_of_water%3F
- 1 2 3 4 5 6 "water." Britannica.com
- ↑ http://www.ntvmsnbc.com/id/25300061/
Dış bağlantılar
- İngilizce Wikipedia, 2006-12-09 tarihli Su maddesi
- Doğada su, National Geographic, Mayıs 2007, tarihten sayfalar, s. 164, ISSN 1302-8464
- "Suyun Özkütlesi". 2014-05-29. 2016-03-07 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20160307045334/http://su.gen.tr/suyun-ozkutlesi.html.
- {{Web kaynağı | url = http://www.su.gen.tr/suyun-molekul-yapisi.html | başlık = Suyun Molekül Yapısı | yazar = | tarih = 2014-05-16 | eser = | yayıncı = | erişim_tarihi = 2015-01-26 | arşivurl = http://web.archive.org/web/20151115020729/http://su.gen.tr:80/suyun-molekul-yapisi.html | arşivtarihi = 2015-11-15}
![]() Wikimedia Commons'ta Su ile ilgili çoklu ortam kategorisi bulunur.
Wikimedia Commons'ta Su ile ilgili çoklu ortam kategorisi bulunur.
