Biyobirikim
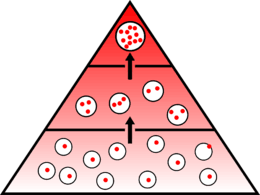
Biyobirikim ya da biyoakümülasyon, pestisit gibi toksinlerin ya da çevrede nadir bulunan yararlı ve gerekli oligoelementler gibi bazı kimyasal maddelerin bitkiler, hayvanlar, mantarlar ya da mikroorganizmalar gibi organizmaların canlı ya da cansız bölümlerinde ya da organizmalarının tamamında soğurularak birikmesini anlatan bir terimdir. Biyobirikim bir organizmanın muhtemelen toksik bir maddeyi katabolizma ya da boşaltım yolu ile yok etmesinden daha hızlı bir oranda soğurmasıyla ortaya çıkar. Dolayısıyla toksik maddenin çevrede ölçülmüş konsantrasyonu çok yüksek olmasa bile biyolojik yarı ömrü ne kadar uzunsa bu nedenle oluşabilen kronik zehirlenme riski o kadar büyüktür.[1] Aynı organizmada görülen biyobirikim yaş ya da sağlık durumu gibi içsel faktörlerden olduğu kadar mevsim, çevrede bulunan besin miktarı, ortamın pH oranı gibi dışsal faktörlerden de oldukça önemli derecede etkilenir. Aynı tür içinde bazı bireyler genetik olarak biyobirikime daha çok ya da daha az yatkın olabilir ancak genel olarak bazı cinsler biyobirikime daha yatkındır; örneğin Agaricus türü mantarların cıva, kurşun, kadmiyum ve selenyum gibi elementleri çok iyi biriktirdikleri bilinmektedir.[2] Biyobirikim, örneğin balıklar için modelleme yoluyla öngörülebilir.[3] Biyodönüşüm kimyasal maddelerin organizmalarda oluian biyobirikimini önemli şekilde etkiler.[4]
Biyoyoğunlaşma ilgili ama daha dar kapsamlı bir terimdir ve kimyasal maddelerin yalnızca su yoluyla alınması ve birikimi için kullanılır. Buna karşın biyobirikim tüm kaynaklardan (örneğin su, besin, hava vb.) kimyasal maddelerin alınmasını kapsar.
Çevre sağlığı ve kirliliği
Kirli çevrelerde ya da biyobirikime uygun bazı toksik maddelerin doğal olarak zengin olduğu çevrelerde bu toksik maddelerin biyobirikimi bireyi ve türü her zaman kötü olarak etkilemez. Örneğin likenler ve mantarlar, hayvanlar için toksik olan radyoizotopları ve metalleri büyük miktarda biriktirebilmekte ve bundan kötü yönde etkilenmemektedirler[5]; hatta biriktirilen metaller sporların daha iyi üremesine ve bitkilerle olan simbiyozun kalitesinin artmasına neden olmaktadır.[6] Biyobirikim kapasitesi asitli topraklar, kirli topraklar, radyoizotoplar ve ağır metaller[7][8][9] arsenik gibi toksik yarı metallerin[10] biyoyayarlanımını ve hareketliliğini artıran asit yağmurları gibi bazı durumlarda artış gösterir. Su ortamlarında toksik maddeleri doğal olarak içeren ya da aldığı toksik maddeleri dönüştüren tortu tabakası toprak rolünü üstlenir.[11] Toksik maddenin kimyasal biçimi de biyobirikim için önem taşır. Örneğin cıva, metalik ya da metil cıva biçimlerinde farklı şekillerde soğurulur[7] ve bu durumda toprağın pH oranı, iyon değişimi yapma kapasitesi, içinde bulunan karmaşık organik kimyasal bileşikler de etkili olur.[12].
Trofik düzeyleri içinde en çok biyobirikim yapan türler genellikle filtreleme yapan organizmalar ile mantarlardır. Mantarlar aynı zamanda yağmurlarla atmosferin temizlenmesi sırasında, örneğin Çernobil reaktör kazası sonrası atmosfere karışan sezyum[13] gibi kimyasal maddeleri de biriktirebilirler. Bu birikimden sonra besin ağında biyoyoğunlaşma denen fenomen görülür.
Besin ağının altında yer alan üreticiler besin ağındaki tüketiciler tarafından tüketildikçe biyobirikim çevre sağlığı sorunlarına yol açar. Örneğin Fransa'da Sen Nehri'nin sularında yaşayan balıklarda bulunan demir, kalsiyum ya da ftalat oranlarının nehir sularında aynı maddelerin bulunma oranlarının 10 ila 1000 katı arasında olduğu görülmektedir. Demirin ve kalsiyumun biyobirikimi, balıklar homeostaz ile vücutlarındaki fazlalıklardan kurtulabildiği sürece sağlıklı olmalarına yarayan fizyolojik mekanizmalar arasındadır. Ancak canlı organizmalar için yararı olmayan ve hatta en kötü durumda canlıların üreme ve büyüme işlevlerini etkileyen ftalatların biyobirikimi çevresel zehirlenme sayılmaktadır.
Kaynaklar
- ↑ Bioaccumulation of Marine Pollutants [and Discussion], by G. W. Bryan, M. Waldichuk, R. J. Pentreath and Ann Darracott Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences.
- ↑ Stijve, T., Besson, R., 1976. Mercury, cadmium, lead and selenium concentration of mushroom species belonging to the genus Agaricus. Chemosphere 51, 151–158
- ↑ Stadnicka, J; Schirmer, K; Ashauer, R (2012). Predicting Concentrations of Organic Chemicals in Fish by Using Toxicokinetic Models. Environ. Sci. Technol. DOI:10.1021/es2043728
- ↑ Ashauer, R; Hintermeister, A; O'Connor, I; Elumelu, M, et al. (2012). Significance of Xenobiotic Metabolism for Bioaccumulation Kinetics of Organic Chemicals in Gammarus pulex. Environ. Sci. Technol. DOI:10.1021/es204611h
- ↑ Allen, R.O., Steinnes, E., 1978. Concentrations of some potentially toxic metals and other trace elements in wild mushrooms from Norway. Chemosphere 4, 371–378.
- ↑ Influence des métaux lourds sur la germination des spores de champignons endomycorhiziens à arbuscules dans les sols LEYVAL C. ; WEISSENHORN I. ; GLASHOFF A. ; BERTHELIN J. (CNRS Univ. Nancy I) ; Journal Title Acta botanica gallica ; ISSN 1253-8078 ; Congrès Mycorhizes. Journée d'étude, Paris, FRANCE (19/11/1993) 1994, vol. 141, no 4 (182 p.) (8 ref.), Şablon:P., Ed:Société botanique de France, Lille, France
- 1 2 Alonso, J., Salgado, M.J., Garcia, M.A., Melgar, M.J., 2000. Accumulation of mercury in edible macrofungi: influence of some factors. Arch. Environ. Contam. Toxicol. 38, 158–162.
- ↑ Gast, C.H., Jansen, E., Bierling, J., Haanstra, L., 1988. Heavy metals in mushrooms and their relationship with soil haracteristics. Chemosphere 17, 789–799.
- ↑ Falandysz, J., Chwir, A., 1997. The concentrations and bioconcentration factors of mercury in mushrooms from the Mierzeja Wislana sand-bar, Northern Poland. Sci. Total Environ. 203, 221–228.
- ↑ Slekovec, M., Irgolic, K.J., 1996. Uptake of arsenic by mushrooms from soil. Chem. Spec. Bioavalab. 8, 67–73.
- ↑ Kannan, K., Smith, R.G., Lee, R.F., Windom, H.L., Heitmuller, P.T., Macauley, J.M., Summers, J.K., 1998. Distribution of total mercury and methyl mercury in water, sediment and fish from South Florida estuaries. Arch. Environ. Contam. Toxicol. 34, 109–118.
- ↑ Bargagli, R., Baldi, T., 1984. Mercury and methyl mercury in higher fungi and their relation with the substrata in a cinnabar mining area. Chemosphere 13, 1059–1071.
- ↑ Bakken, L.R., Olsen, R.A., 1990. Accumulation of radiocaesium in fungi. Can. J. Microbiol. 36, 704–710.