Brønsted–Lowry asit–baz kuramı
Brønsted–Lowry asit–baz kuramı, Johannes Nicolaus Brønsted ve Thomas Martin Lowry'nin birbirlerinden bağımsız oluşturdukları bir asit-baz tepkime kuramıdır. Kuramın temel kavramı asitlerin proton (H+ iyonu) veren maddeler, bazların ise proton alan maddeler olarak tanımlanmasıdır.
Asit ve bazların özellikleri
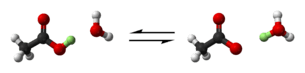
Zayıf bir asit olan asetik asit, suda çözünürken suya proton (hidrojen iyonu, yeşille gösterilen) verir. Denge tepkimesinin sonucunda hidronyum ve asetat iyonları oluşur. Burada asetik asit asit, su ise bazdır. Kırmızı: oksijen, siyah: karbon, beyaz: hidrojen.
Brønsted–Lowry asit-baz tanımı Arrhenius tanımının genişletilmiş halidir. Arrhenius kuramına göre hidroksil grubu içeren maddeler bazken bu kurama göre H+ alan tüm maddeler bazdır. Dolayısıyla Arrhenius tanımına göre asit olan her madde Brønsted–Lowry tanımına göre de asittir.
Kurama göre asit-baz tepkimelerinde asit kendisinin eşlenik bazına, baz da kendisinin eşlenik asidine dönüşür. Yani:
- asit + baz
 eşlenik baz + eşlenik asit.
eşlenik baz + eşlenik asit.
Kaynakça
- Anadolu Üniversitesi. "Asitler ve Bazlar". 17 Temmuz 2012 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20120717031642/https://www.anadolu.edu.tr/aos/kitap/EHSM/1222/unite11.pdf. Erişim tarihi: 12 Şubat 2014.
This article is issued from Vikipedi - version of the 12/12/2015. The text is available under the Creative Commons Attribution/Share Alike but additional terms may apply for the media files.