Denitrifikasyon
 |
Bu maddenin veya maddenin bir bölümünün gelişebilmesi için konuda uzman kişilere gereksinim duyulmaktadır. Ayrıntılar için maddenin tartışma sayfasına lütfen bakınız. Konu hakkında uzman birini bulmaya yardımcı olarak ya da maddeye gerekli bilgileri ekleyerek Vikipedi'ye katkıda bulunabilirsiniz. |
Denitrifikasyon ya da nitrat solunumu, nitrat ve nitrit bileşiklerinin, anaerobik koşullarda mikroorganizmalar tarafından redüksiyona Uğratılarak elementer azota dönüştürülmesi olayı.[1][2][3]
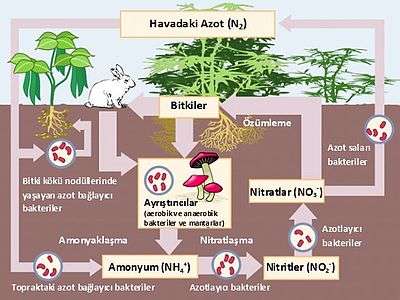
Atmosferin %78'ini oluşturan azot, canlılardaki temel besin maddelerinden biridir. Gerek canlı bünyesinde ve gerekse ölü organizmalarda bulunan azot, doğada “azot çevrimi” denilen bir döngü içinde sürekli dolanım halindedir. Biyolojik denitrifikasyon, bu çevrimin önemli aşamalarından biridir[4].
Azot çevrimi
Toprakta bulunan organik azotlu maddeler, proteinler, çekirdek asitleri, Pürin ve pirimidin bazları, glikozamin ve galaktozamin gibi amino şekerlerdir. Topraktaki proteinler, mikroorganizmalarıN hücre dışına saldığı "proteinaz" enzimleriyle amino asitlere parçalanırlar. Bu faaliyetler sonunda meydana gelen amino asitler, ya yine mikroorganizmalar tarafından besin olarak kullanılır veya daha KüçüK bileşenlerine ayrıştırılırlar.[5]
Bitkiler, azotu genellikle nitrat şeklinde alırlar. Topraktaki nitrat birikimi ise proteinlerin parçalanma ürünü olan amonyağın mikrobiyal oksidasyonuyla oluşur. Bu olay, iki basamakta gerçekleştirilir. Birinci basamakta amonyak nitrite çevrilir ve "nitrosifikasyon" denen bu olayda başlıca Nitrosomonas, Nitrosospira, Nitrosococcus ve Nitrosolobus cinslerine ait bakteri türleri etkin rol oynarlar. İkinci basamakta ise nitrit, Nitrobacter cinsine ait bakteri türleri tarafından nitratlara çevrilir (nitrifikasyon) [6]. Bu olaylarla ilgili denklemler aşağıda verilmiştir [4].[5][7][8]
- 55NH4 + 76O2 + 109HCO3 → C5H7O2N* + 54NO2 + ::104H2CO3
- 400NO2 + NH4 + 4H2CO3 + HCO3 + 195O2 → C5 H7 ::O2N* + 3H20 +400NO3
Mikrobiyal faaliyetler sonucunda meydana gelen nitratlar, eğer hemen bitkiler tarafından alınmazsa yine topraktaki bazı bakteriler tarafından redüksiyona uğratılır ve bu şekilde nitritler, amonyak ve elementer azot oluşur (denitrifikasyon) ve toprak nitrat bakımından fakirleşir.[1][2][3][4][5] Karbon kaynağı olarak metanolün kullanıldığı denitrifikasyonaait sitokiyometrik bağıntı aşağıda verilmiştir.[9][10][11]
- NO3+ 1, 08CH3OH + H → 0, 065C5H7O2N* + 0, 467N2 + 0, 76CO2 + 2, 44H20 (*)
(*) Bu denklemlerde bakteri hücre formülü olarak C5H7O2N alınmıştır.
Nitratlar bitkiler tarafından alınınca, bunların önemli birbölümü protein moleküllerinin yapımında kullanılır. Bitkisel proteinleri yiyen hayvanlar, onları hayvansal proteine çevirirler. Hayvanların protein metabolizması sonunda, artıK madde olarak üre ve ürik asit gibi azotlu bileşikler dışarı atılır ve bunlardan amonyak oluşur. Diğer taraftan, ölü hayvanların ve bitkilerin proteinlerinin parçalanmasıyla peptonlar, peptidler, amino asitler ve sonunda amonyak ortaya çıkar (mineralizasyon ve amonifikasyon)[5].
Azot çevriminde önemli bir başka olay da, havanın 4/5’ünü oluşturan serbest azotun bağlanmasıdır. Bu olay, biri simbiyotik diğeri simbiyotik olmayan iki farklı yolla gerçekleşIr. Simbiyotik azot bağlanmasında, baklagil bitkilerinin Köklerine yerleşen ve burada yumrular oluşturan Rhizobium meliloti ve Rhizobium leguminosarum gibi bakteriler rol almaktadır. Ayrıca bazı küf mantarları ve aktinomisetlerin de bitkiler ile simbiyotik yaşayarak azot bağladıkları ifade edilmektedir. Simbiyotik olmayan azot bağlanması olayında ise nötral reaksiyonlu toprakta Azotobacter gibi, asit reaksiyonlu toprakta ise Clostridium pasteurianum gibi, alkali topraklarda ise siyanobakteriler gibi bakteriler görev alırlar. Bu özelliğe sahip bakteriler, sentezledikleri "nitrogenaz" enzimleri sayesinde serbest azot bağlama yeteneğindedirler.[5].Şekil 1.’de azot çevrimi ve etkili mikroorganizmalar özetlenmiştir[12].
Denitrifikasyonun mekanizması ve üzerinde etkili faktörler
Denitrifikasyon olayında, nitratın elementer azota indirgenmesi dört basamakta gerçekleşmekte (NO3 − NO2 − NO− N2O – N2) ve Bu basamakların her biri ayrı bir enzim sistemi tarafından katalizlenmektedir. Denitrifikasyon bakterilerinde membrana bağlı olan bu enzimlerin sentezi anaerobik şartlarda gerçekleştirilir. İlk basamağı oluşturan nitratların nitritlere indirgenmesinde, molibden içeren membrana Bağlı "nitrat redüktaz" enzimi rol almakta, nitritlerin indirgenmesini ise, birinin merkezinde bakır, diğerinin merkezinde ise iki tane hem grubu olan iki farklı "nitrit redüktaz" enzimi tarafından yürütülmektedir.
Diğer taraftan azot oksitlerin (NO) indirgenmesindeki enzimatik olaylar aydınlığa kavuşturulmamakla beraber, denitrifikasyonun son safhasını oluşturan N2O’In elementer azota indirgenmesinde "N2O redüktaz" denen enzimin görev aldığı ve bu enzimin bakır içeren bir sitoplazmik enzim olduğU belirtilmektedir.[11][13][14][15][16]
Denitrifikasyon enzimleriyle ilgili çalışmalar daha çok Paracoccus denitrificans, Escherichia coli, Pseudomonas aeruginosa ve Pseudomonas stutzeri türleri üzerinde yapılmıştır. Bu ayrıntılı çalışmalar sonucunda "nitrat redüktaz" enziminin a,b, ve d olmak üzere üç alt üniteden meydana geldiği, bunlardan a-alt ünitesinin molibden kofaktörünü taşıdığı, b-alt ünitesinin FeS gruplarını içerdiği ve d-alt ünitesinin ise sitokrom-B taşıdığı saptanmıştır.[13]. Oldukça yüksek çözünebilirlikte olan enzim membrana bağlı, molibdo-proteindir, sadece anaerobik şartlar altında sentezlenmektedir.[17]. Nitrit redüktaz, bakır Içeren hemgrubu bulunmayan bir enzimdir [18]. Bundan Başka nitrik oksit redüktaz henüz saflaştırılmamıştır.[17]. Nitroz oksit redüktaz ise hem-grubu Içermeyen, bakır Içeren bir enzimdir [17].
Denitrifikasyonun genetik temeli de araştırılmış ve en az 40 genin Bu olay üzerinde etkili olduğu sonucuna varılmıştır.[13]. Bazı bakteri türlerinin enzim sistemleri üzerinde yapılan ayrıntılı araştırmalar sonucunda, enzimlerin sentezlenmesi ve baskılanmasını etkileyen faktörlerin genel olmadığı, Bu durumun ise denitrifikasyonda rol alan bakterilerin genetik çeşitliliğinden ve dolayısıyla metabolik farklılıklarından kaynaklandığı belirlenmiştir. Örneğin Paracoccus denitrificans türü ile yapılan çalışmalarda "nitrat redüktaz" ve "nitrit redüktaz" üretiminin ayrı substratlarla başlatıldığı bildirilmektedir. Nitrat redüktaz enzimi, oksijen ya da nitrit tarafından (0,1 mm) inhibe edilmezken, nitrit redüktazın aktivitesi, oksijen varlığında önemli ölçüde inhibe edilmiştir. Ortamda her iki enzimin bulunması durumunda ise, nitratın nitrite tercih edildiği kaydedilmiştir.[11][14][19]
Denitrifikasyon yapma yeteneğine sahip mikroorganizmalar, nitratlardan üç şekilde yararlanmaktadır:
- Azot kaynağı olarak,
- Nitratı nitrite, nitriti de amonyağa indirgemek suretiyle nitrat asimilasyonunda,
- Nitratı, oksijen yerine son elektron AlıcıSı olarak .[1][20]
Denitrifikasyon, bir solunum olayı olduğundan, enerji kaynağı olarak oksitlenebilir bir substrat ya da elektron vericisine ihtiyaç vardır. Denitrifiye edici bakteriler çoğunlukla heterotrof olup, kompleks organik maddeleri oksitlenebilir substrat olarak kullanırlar. Ancak bazı denitrifikasyon bakterileri ise ototrofturlar ve H2, CO2 ya da Kükürt bileşiklerini enerji kaynağı olarak kullanırlar.[11][21]
Heterotrofik denitrifikasyonda metanol, etanol, glikoz, asetik asit ve formik asit gibi birçok organik madde karbon kaynağı olarak kullanılmaktadır.[22][23][24][25][26][27]. Ayrıca metan ve karbonmonoksit gibi gaz halindeki organik maddeler de substrat olarak kullanılabilmektedir. Metan gazının elektron vericisi olarak kullanıldığı denitrifikasyonun mekanizması hakkındaki bilgiler birtakım çelişkiler içermekle beraber, gaz halindeki karbon kaynakları içerisinde en kapsamlı çalışılan substrat, metandır.
Araştırıcılar, metan oksidasyonunun aerobik ya da mikroaerofilik şartlara ihtiyaç duyduğunu ileri sürmüşler ve bu denitrifikasyonun farklı iki mikroorganizmanın simbiyotik ilişkisi sonucu gerçekleşebildiğini belirtmişlerdir.[28]. Karbonmonoksitin kullanıldığı çalışmalar ise çok daha az sayıdadır. Yukarıda da belirtildiğI gibi denitrifikasyon olayı, hidrojen ve çeşitli indirgenmiş Kükürt bileşiklerini enerji kaynağı olarak kullanabilen ototrofik bakteri türleri tarafından da gerçekleştirilmektedir (ototrofik denitrifikasyon). Ototrofik üreme koşullarında herhangi bir dış organik karbon kaynağına ihtiyaç duyulmamakta, daha çok karbondioksit ve bikarbonat, hücre sentezi için karbon kaynağı olarak kullanılmaktadır. Diğer taraftan Paracoccus denitrificans ve Thiobacillus denitrificans gibi bazı bakteri türleri hem ototrofik hem de heterotrofik denitrifikasyon yapabilmektedir.[14]. Ayrıca Ferrobacillus, Gallionella, Leptothrix ve Sphaerotilus cinslerine ait bakteriler 〖Fe〗^(+3)’ ü enerji kaynağı olarak kullanmak suretiyle denitrifikasyon yapmaktadırlar. Aşağıda sırasıyla hidrojen, tiyosülfat ve elementer Kükürt kullanımına ilişkin sitokiyometrik bağıntılar verilmiştir.[10][11][29][30]
- 2NO3 + 5H2→ N2 + 4H2O + 2OH
- 5S2 O3 + 8NO3 → 4N2 + 10SO4 + 2H
- 10NO3+ 115SO + 4, 1HCO3 + 0, 5CO2+ 1, 71NH4 + 2, 54H2O →-0, 92C5 H7NO2 + 11SO4 + 5, 4N + 962H
Biyolojik denitrifikasyonun azot çevrimindeki rolüne ilâveten içme sularında biyolojik NO3 arıtımı Için de kullanılabileceğinin anlaşılması, işlemi daha verimli hale getirmek Için optimum parametrelerin belirlenmesi çalışmalarını da hızlandırmıştır. Yapılan araştırmalar, denitrifikasyon bakterilerinin metabolizmasında elektron alıcısı olarak nitratla rekabet eden oksijenin önemli bir inhibitör olduğunu ve 0,2Mg/L’nin üzerindeki oksijen konsantrasyonlarında nitrat indirgenmesinin gerçekleşmediğini göstermiştir.[31][32]. Ancak Pseudomonas ve Bacillus cinslerine ait birkaç mikroorganizmanın aerobik şartlarda da NO3’ı elektron alıcıSı olarak kullanmak suretiyle denitrifiye edebileceğI belirtilmektedir.[33]. Diğer taraftan, denitrifikasyon sırasında hücrelerde ki NADH dehidrogenaz, suksinat dehidrogenaz ve metanol dehidrogenaz gibi H2 koparılmasını katalizleyen enzimlerin de rol oynadıkları belirlenmiştir.[16].
Araştırıcılar, denitrifikasyon Için optimum pH aralığının pH5−8, SıcaklıK sınırlarının ise 4-60 °C olduğunu, Bu sınırlar dışındaki değerlerde ise denitrifikasyonun gerçekleşmediğini kaydetmişlerdir.[34].
BunlarıN dışında oksijen seviyesi, C/N oranları, nitrat konsantrasyonu, tuz, iz elementler gibi çoğu çevresel faktöründe denitrifikasyon üzerinde etkili olduğU rapor edilmiştir.[35][36][37][38][39]
Denitrifikasyon üzerinde inhibitör etkisi olan bileşiklerin başında Kükürt bileşikleri gelmektedir. Aynı zamanda, çok az miktarlarda bulunsa bile nitratın NO → N2O dönüşümünü, enzim aktivitesini baskılamak suretiyle engellediği belirtilmektedir .[7][10]
Denitrifikasyon yapan bakteriler
Denitrifikasyon olayı, Proteobacter’lerden ve Archaea’lere kadar olan prokaryotlar arasında geniş bir dağılım göstermektedir.[40].[41] Denitrifikasyon üzerinde yapılan çok sayıdaki araştırma sonucunda, Achromobacter, cinetobacter, Aeromonas, Alcaligenes, Aquaspirillum, Azospirillum, Bacillus, Beggiatoa, Chromobacterium, Clostridium, Desulfovibrio, Erythrobacter, Gallionella, Halobacterium, Halomonas, Hyphomicrobium, Neisseria, Paracoccus, Propionibacterium, Psedomonas, Rhizobium, Rhodopseudomonas, Thiobacillus, Vibrio ve Xanthomonas cinslerine ait çok sayıda bakterinin denitrifikasyon aktivitesine sahip olduğU saptanmıştır [11]
Her Ne kadar denitrifikasyon yapan bakteri sayısı fazla ise de, NO3 giderimi amacıyla üzerinde araştırma yapılan türlerin başlıcaları Pseudomonas aeruginosa, Pseudomonas fluorescens, Pseudomonas stutzeri, Paracoccus denitrificans, Thiobacillusdenitrificans ve Bacillus licheniformis’' tir.[2][11][22]
Kaynakça
- 1 2 3 ÇelebioğLu İ, Et al. 1980. Toprak Mikrobiyolojisi Ders Notları. Atatürk Üniversitesi, Ziraat Fakültesi Yayınları, Erzurum.
- 1 2 3 Schlegel HG. 1986. General microbiology, 6Th edition. Cambridge University Press, London.
- 1 2 Crab R, Avnimelech Y, Defoirdt T, Bossier P, and Verstraete W. 2007. Nitrogen removal techniques In aquaculture for a sustainable production. Aquaculture. 270(1-4): 1-14.
- 1 2 3 Unat EK. 1985. Temel Mikrobiyoloji. Beta Basım Yayım Dağıtım A.Ş. No: 52. İstanbul.
- 1 2 3 4 ] Unat EK. 1985. Temel Mikrobiyoloji. Beta Basım Yayım Dağıtım A.Ş. No: 52. İstanbul
- ↑ Colliver BB, and Stephenson T. 2000. Production of nitrogen oxide and dinitrogen oxide by autotrophic nitrifiers. Biotechnol Adv. 18: 219-232.
- 1 2 Hiscock KM Et al. 1991. Review of natural and artifical denitrification of groundwater. Water Res. 25: 1099-1111.
- ↑ Sawyer C, McCarty PL, Parkin GF. 1994. Chemistry for Environmental Engineering. International Editions, McGraw-Hill Co., 439-453. United States.
- ↑ Dahab MF and Lee YW. 1988. Nitrat removal from water supplies using biological denitrification. Journal of W.P.C.F. 90: 1670-1676.
- 1 2 3 Gayle BP, Et al. 1989. Biological denitrification of water. J Environ Eng. 111: 930-943.
- 1 2 3 4 5 6 7 Mateju V. 1992. Biological denitrification. A rewiev. Enzym Microb Tech. 14: 170-183.
- ↑ Özçelik S. 1985. Genel Mikrobiyoloji. Selçuk Üniversitesi Ziraat Fakültesi, YayıN No: 1. Konya.
- 1 2 3 Verseveld HW Et al. 1983. Energetic aspect of growth of Paracoccus denitrificans. Arch Microbiol. 135: 229-236
- 1 2 3 Gottschalk G. 1985. Bacterial Metabolism, 2Nd edition. Springer- Verlag, 122-126. New York.
- ↑ Verstraete W and van Vaerenbergh E. 1986. Aerobic activated sludge. In: Biotechnology. (ed. Schönborn W), Vol. 8, Microbial degradations. Weinheim, Germany,VCH; 8: 3.
- 1 2 Stouthamer AH. 1991. Metabolic regulation including anaerobic metabolism In Paracoccus denitrificans. J of Bioenerg and Biomembr. 23: 163-185.
- 1 2 3 Payne WJ. 1985. Diversity of denitrifiers and their enzymes. In: Denitrification In the nitrogen cycle. (ed. Golterman HL) Plenum Press, 47-65. New York, NY.
- ↑ Bryan BA. 1981. Physiology and biochemistry of denitrification. In: Denitrification, nitrification, and atmospheric nitrous oxide. (ed. Delwiche CC), John Wiley & Sons, New York, NY.
- ↑ Rick WY, Averill BA and Tiedje JM. 1994. Denitrification: Production and consumption of nitric oxide. Appl Environ Microbiol. 60: 1053-1058.
- ↑ Okada N, Nomura N, Nakajima-Kambe T, and Uchiyama H. 2005. Characterization of the aerobic denitrification In Mesorhizobium sp. strain NH−14In comparison with that In related rhizobia. Microbes Environ. 20: 208-215
- ↑ Hall T. 1991. Biological denitrification for potable water treatment. Extended Summaries, Environ Biotech Group Meeting: London. 185-187.
- 1 2 Smith J, Et al. 1972. Nitrogen removal from municipal waste water by columnar denitrification. Environ Science and Tech. 6: 260-267.
- ↑ Tımmerman P, Et al. 1983. Denitrification with methanol. WaterRes. 17: 1267-1274.
- ↑ Evans PJ, Et al. 1991. Anaerobic degradation of toluene by a denitrifying bacterium. Appl Environ Microb. 57: 1139-1145.
- ↑ Akunna JC, Et al. 1993. Nitrate and nitrite reductions with anaerobic sludge using various carbon sources. Water Res. 27: 1303-1312.
- ↑ Delanghe B, Et al. 1994. Drinking water denitrification of in a membran bioreactor. Wat Sci Tech. 6: 157-160.
- ↑ ] Fass S, Et al. 1994. Volatile fatty acids As organic carbon sources in denitrification. Environ Tech. 15: 459-467.
- ↑ Rhee G, Fuhs G. 1978. Wastewater denitrification with one carbon compounds As energy source. Journal of W.P.C.F. 50: 2111-2119.
- ↑ Kurt M, Et al. 1987. Biological denitrificans of drinking water using autotrophicorganism with hidrogen In a fluidized bed biofilm reactor. Biotech and Bioeng. 29: 493-501.
- ↑ NuhoğLu A. 1996. Çapraz akışlı membran bioreaktörde denitrifikasyon prosesi [Yüksek Lisans]. Atatürk Üniversitesi, Fen Bilimleri EnstitüSü, Erzurum.
- ↑ Cox JC, Ingledew WJ, Haddock BA and Lawford HG. 1978. The variable cytochrome content of Paracoccus denitrificans grown aerobically under different conditions. FEBS Lett. 93: 261-265.
- ↑ Bosma G, Et al. 1987. The respiratory chain and energy conservation in the mitochondrion-like bacterium Paracoccus denitrificans. Microbiol Sci. 4: 329-333.
- ↑ Stanier RY, Doudooff M. and Adelberg EA. 1970. Microbial World, 3rd edition. Prentice-Hall, Inc., Englewood Cliffs, New Jersey
- ↑ Usha S, Et al. 1982. Denitrification potential of a salt marsh soil: Effect of temperature, pH and substrate concentration. Soil Biol Biochem. 14: 117-125.
- ↑ Cervantes F, Monroy O, and Gomez J. 1998. Accumulation of intermediates In a denitrifying process At different copper and high nitrate concentrations. Biotechnology Letters, 20(10): 959-961.
- ↑ Carrera J, Vicent T, and Lafuente FJ. 2003. Influence of temperature on denitrification of an industrial highstrength nitrogen wastewater In a two-sludge system. Water SA. 29(1): 11-16.
- ↑ Estuardo C, Marti MC, HuiliñIr C, Áspe Lillo E, and Roeckel Von Bennewitz M. 2008. Improvement of nitrate and nitrite reduction rates prediction. Electronic Journal of Biotechnology. 11(3): 1-10.
- ↑ Glass C, and Silverstein J. 1998. Denitrification kinetics of high nitrate concentration water: pH effect on inhibition and nitrite accumulation. Water Research. 32(3): 831-839.
- ↑ Glass C, and Silverstein J. 1999. Denitrification of high-nitrate, high-salinity wastewater. Water Research, 33(1): 223-229
- ↑ Yamamoto M, Murai H, Takeda A, Okunishi S andMorisaki H. 2005. Bacterial flora of the biofilm formed on the submerged surface of the reed Phragmites australis. Microbes Environ. 20: 14-24.
- ↑ Zumft WG. 1997. Cell biology and molecular basis ofdenitrification. Microbiol Mol Biol Rev. 61: 533-616.