Klatrat hidrat
Klatrat hidratlar (veya gaz klatratlar, gaz hidratlar), su içeren, kristal yapılı katılardır; birbirine hidrojen bağları kurarak "kafes" yapı oluşturmuş su molekülleri içine hapsolmuş küçük apolar moleküllerdir (tipik olarak gaz molekülleri). Bir diğer deyimle, klatrat hidratlar, kafes bileşiklerdir, konak molekül sudur, konuk molekül de tipik olarak bir gazdır. Hapsolmuş molekülün desteği olmaksızın klatrat hidratların kafes yapısı göçer ve buzun kristal yapısı veya sıvı su meydana gelir. Çoğu düşük moleküler ağırlıklı gazlar (O2, H2, N2, CO2, CH4, H2S, Argon, Kripton ve Ksenon) ayrıca bazı hidrokarbonlar ve freonlar uygun basınç ve sıcaklıkta hidratlar oluştururular. Klatrat hidratlar kimyasal bileşik değildirler çünkü hapsolmuş moleküller kafese bağlı değildirler. Klatrat hidratların oluşumu ve bozunumu birinci dereceden bir faz geçişidir, bir kimyasal tepkime değildir. Moleküler düzeyde bunların oluşum ve bozunum mekanizması henüz iyi anlaşılmamıştır.[1][2] Klatrat hidratlar ilk 1810'da Sir Humphry Davy tarafından belgelenmiştir.[3]
Klatratların doğada büyük miktarlarda var olduğu bulunmuştur. Yaklaşık 6.4 trilyon (yani 6,4x1012) ton metan, okyanus tabanında metan klatrat yatakları içinde hapis durumdadır.[4] Bu yataklar Norveç kıta sahanlığında, Storegga Kayması'nın kuzey yamacında bulunabilir. Klatratlar tiyal (permafrost) içinde de bulunabilirler, kuzeybatı Kanada'da Mackenzie Deltasındaki Mallik gaz hidrat sahasında olduğu gibi. Bu doğal gaz hidratları muazzam bir enerji kaynağı olarak görülmektedirler ama ekonomik bir çıkarma yöntemi henüz bulunmamamıştır. Hidrokarbon klatratları petrol endüstrisi için problem yaratırlar çünkü bunlar petrol borularında oluşup çoğu zaman tıkanmaya yol açarlar. Deniz dibinde karbon dioksit klatratı oluşturulması, atmosferdeki sera gazlarının giderilmesi ve iklim değişikliğinin önüne geçmek için bir yöntem olarak öne sürülmüştür.
Klatratların bazı dış planetlerde, aylarda ve Neptün ötesi cisimlerde çok miktarda bulunduğu tahmin edilmektedir.
Yapı
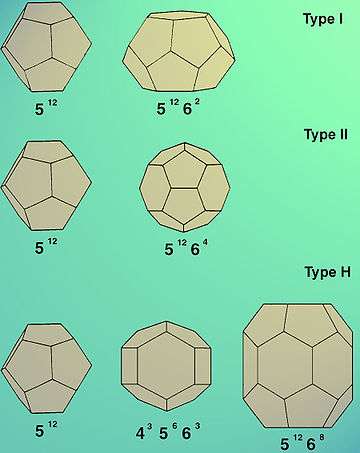
Gaz hidratlar genelde iki kristalografik kübik yapı oluşturur; bunlar yapı (tip) I ve yapı (tip) II olarak adlandırılır[5] ve sırasıyla ve uzay gruplarına karşılılık gelir. Nadir olarak uzay grubuna ait üçüncü bir altgensel yapı da (Tip H) görülebilir.[6]
Tip I'in birim hücresi 46 su molekülünden oluşur, bunlar biri küçük, biri büyük iki tip kafes meydana getirir. Birim hücrede Küçük kafesten iki tane, büyük olandan altı tane vardır. Küçük kafes beşgenli bir dodekahedron (512), büyük olan ise bir tetradekahedron (ondört yüzlü), daha doğrusu, altıgen kesimli trapezohedron'dur (51262), bunlar beraberce bir Weaire-Phelan yapısı oluşturur. Tip I hidratları oluşturan tipik konuklar, karbon dioksit klatrat içinde bulunan CO2 ve metan klatrat içinde bulunan CH4'tür.
Tip II birim hücresi 146 su molekülünden oluşur, bunlar da iki tip kafes meydana getirir - küçük ve büyük. Bu durumda 16 küçük kafesle birlikte sekiz büyük kafes vardır. Küçük kafesin yapısı gene beşgenli dodekahedrondur (512) ama büyük olan bir heksadekahedrondür (16 yüzlü). Tip II hidratlar O2 ve N2 gibi gazlardan oluşur.
Tip H'nin birim hücresi 34 su molekülünden oluşur, bunlar üç tip kafes meydana getirir: iki farklı küçük tip ve bir büyük tip. Bu durumda birim hücrede üç adet 512 tipli küçük kafes, oniki adet 435663 tipli küçük kafes ve bir büyük 51268 kafes vardır. Tip H'nin kararlı bir şekilde meydan gelmesi iki konuk gazın (büyük ve küçük) işbirliğini gerektirir. Büyük boşluk büyük moleküllerin (örneğin butan, hidrokarbonlar) yerleşmesini sağlar, ama bunun için yardımcı küçük gazların diğer boşlukları doldurup onların yapısını desteklemesi gerekir.
Dünyada hidratlar
Doğal gaz hidratları
Dünyada gaz hidratlar doğal olarak deniz tabanında, okyanus dibindeki tortularda, derin göllerdeki tortularda (örneğin Baykal Gölü) ve tiyal (permafrost) bölgelerde bulunur. metan hidrat yataklarında önemli miktarda metan olabileceği (1015 ila 1017 metre küp) iddia edilmiştir.[7] bunlar potansiyel bir enerji kaynağı olarak büyük öneme sahiptir. Bu yatakların bozunması ile metanın toplu şekilde atmosfere salınması küresel bir iklim değişikliğine yol açabilir, çünkü atmosferik metan karbon dioksitten de daha etkili bir sera gazıdır. Bu tür metan yatakların hızlı bozunumu bir jeolojik afet yaratabilir, toprak kayması, zelzele ve tsunamiye yol açma potansiyelinden dolayı. Doğal gaz hidratları sadece metan değil, diğer hidrokarbon gazları, hidrojen sülfür ve karbon dioksit de içerirler. Kutuplardaki buz örneklerinin içinde hava hidratlarına a sıklıkla rastlanır. Tiyal bölgelerdeki Pingolarda da metan hidrat bulunur[8]. Similar structures are found in deep water related to methane leakages.
Boru hatlarında gaz hidratları
Boru hatlarında hidrat oluşumu için uygun termodinamik şartlar sık sık oluşur. Bu arzu edilmeyen bir olaydır çünkü klatrat kristalleri kümelenip boruyu tıkayabilir.[9] Petrolün zamanında teslim edilememesinden kaynakalanan ekonomik zararların yanı sıra, valv ve cihazlara da zarar gelir.
Hidrat oluşumunu engelleme
Hidratlar kümelenip boru duvarına yapışma eğilimi gösterirler ve bunun sonucunda boru tıkanır. Hidratlar oluşunca sıcaklık artırılarak ve/veya basınç azaltılarak bunların bozunması sağlanabilir. Bu şartlarda dahi klatrat bozunumu yavaş bir süreçtir. Dolayısıyla, temel çözümü problemin meydana gelmesini engellemekle başlar. Bu konuda yapilabilecek olanlar şunlardır:
- Glikol kurutması ile hidrat oluşum sıcaklığını düşürmek.
- Geçici olarak işlem sıcaklığını değiştirmek
- Hidrat denge şartlarını daha düşük sıcaklık ve daha yüksek basınca doğru değiştirmek veya reaksiyon inhibitörleri kullanarak hidrat oluşum süresini artırmak.
İzlenecek yöntemler, basınç, sıcaklık, malzeme (gaz, sıvı, suyun varlığı, vb) gibi işletim şartlarına bağlıdır.
Hidrat inhibitörleri
Hidratların oluşabileceği parametreler dahilinde çalışırken bunların oluşumunu engellemek gene de mümkündür. Gerekli kimyasallar eklenerek gazın terkibini değiştirilir, böylece hidrat oluşum sıcaklığı azaltılır ve/veya oluşum geciktirilir. Genelde iki seçenek vardır.
- Termodynamik inhibitörler
- Kinetik inhibitörler/anti-kümelendiriciler
En yaygın termodinamik inhibitörler metanol, monoetilen glikol (MEG) ve dietilen glikoldur (DEG). Bu sonuncusuna glikol olarak değinilir. Bunların hepsi karışımdan geri alınabilir ve tekrar kullanılabilir ama genelde metanolun tekrar kullanımı ekonomik değildir. Sicaklığın −10 °C ve altında olduğu uygulamalarda MEG, DEG'e tercih edilir, yüksek vizkozite ve düşük sıcaklıktan dolayı. Trietilen glikol'un buhar basıncı fazla düşüktür, bir gaz akımına enjekte etmek uygun değildir. MEG ve DEG'e kıyasla metanolün daha büyük bir oranı gaz fazına geçip kaybolur.
Kinetik inhibitörler ve anti kümelendiricilerin saha operasyonunda kullanılması hâlen yeni ve gelişmekte olan bir teknolojidir. Ayrıntılı testler ve optimizasyon gerekmektedir. Kinetik inhibitörler çekirdeklenmeyi engellemesine karşın, anti kümelendiriciler gaz hidrat kristallerinin birbirine yapışmasını engellerler. Bu iki tip inhibitör düşük dozajlı hidrat inhibtörleri olarak bilinir çünkü konvansiyonel termodinamik inhibitörlerden çok daha düşük konsantrasyonlara gerek gösterirler. Kinetik inhibitörler (ki etkili olmak için su ve hidrokarbon karışımı gerektirmezler) genelde polimer veya kopolimerlerdir. Anti-kümelendiriciler ise su ve hidrokarbon karışımı gerektirir ve çift kutuplu (zwitterionic) sürfaktanlardan oluşur, bu sürfaktanlar hem hidratlar hem de hidrokarbonlara bağlanarak etki eder.
Ayrıca bakınız
- Klatrat
- Klatrat tabanca hipotezi
Kaynakça
- ↑ Gao, S; House, W; Chapman, WG; House W, Chapman WG (2005). "NMR MRI Study of Gas Hydrate Mechanisms". The journal of physical chemistry. B (American Chemical Society) 109 (41): 19090–19093. DOI:10.1021/jp052071w. PMID 16853461. http://www.scribd.com/doc/9701479/NMR-MRI-Study-of-Gas-Hydrate-Mechanisms. Erişim tarihi: August 3, 2009.
- ↑ Gao S; Chapman WG, House W (2005). "NMR and Viscosity Investigation of Clathrate Formation and Dissociation". Ind.Eng.Chem.Res. (Americal Chemical Society) 44: 7373–7379. DOI:10.1021/ie050464b. http://www.scribd.com/doc/9701466/NMR-and-Viscosity-Investigation-of-Clathrate-Formation-and-Dissociation. Erişim tarihi: August 3, 2009.
- ↑ Ellen Thomas (November 2004). "Clathrates: little known components of the global carbon cycle". Wesleyan University. 19 Haziran 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150619161430/http://ethomas.web.wesleyan.edu:80/ees123/clathrate.htm. Erişim tarihi: 13 December 2007.
- ↑ Buffett, B.; Archer, D. (2004). Global inventory of methane clathrate: sensitivity to changes in the deep ocean.. ss. 185–199. Earth Planet. Sci. Lett. 227 (2004).
- ↑ von Stackelberg, M. & Müller, H. M. (1954) Zeitschrift für Elektrochemie 58, 1, 16, 83
- ↑ Sloan E. D., Jr. (1998) Clathrate hydrates of natural gases. Second edition, Marcel Dekker Inc.:New York.
- ↑ http://www.newscientist.com/article/dn16848-ice-that-burns-could-be-a-green-fossil-fuel.html Ice that burns could be a green fossil fuel New Scientist 26 March 2009 by Michael Marshall
- ↑ Ussler, W.; Paull, C. K.; Lorenson, T.; Dallimore, S.; Medioli, B.; Blasco, S.; McLaughlin, F.; Nixon, F. M. (December 2005). "Methane Leakage from Pingo-like Features on the Arctic Shelf, Beaufort Sea, NWT, Canada". Physics Abstract Service. SAO/NASA ADS. http://adsabs.harvard.edu/abs/2005AGUFM.C11A1069U. Erişim tarihi: 2008-03-09.
- ↑ Shuqiang Gao, “Investigation of Interactions between Gas Hydrates and Several Flow Assurance Elements”, Energy and Fuels, 22 (5), 3150–3153, 2008.