Kompleman sistemi
Kompleman sistem , Komplement sistemi veya tamamlayıcı sistem, bir canlıdan patojenlerin temizlenmesine yardım eden biyokimyasal bir kaskaddır. Bağışıklık sisteminin bir canlının yaşamı süresindeki gidişlerle değişmeyen ve uyum sağlamayan doğuştan gelen bağışıklık sistemine ait geniş kısımlarıdır. Bununla beraber edinilmiş bağışıklık sistemiyle birlikte işleme konulup, eyleme geçirilebilir.
Kompleman sistem, normalde zimogenler diye bilinen dolaşan kanda inaktif olan bulunan proteinlerinin küçük miktarını içerir. Bazı tetikleyiciler tarafından uyarıldığında, sistemdeki proteazlar özgül proteinlere sitokinleri salgılatmak üzere ayrılırlar ve daha ileri ayrılmaları yükseltecek kaskadları başlatırlar. Bu kaskadın aktivasyonun sonucu, hücre-öldürücü yüzey saldırı kompleksinin etkinleştirilmesi ve yanıtının oldukça yükseltilmesidir. Serum proteinleri, serozal proteinler ve hücre yüzeyi proteinlerini kapsayan 20'nin üzerinde protein ve protein parçaları kompleman sistemini düzenler. Bu proteinler ana olarak karaciğer tarafından sentezlenirler ve kan serumunun globulin yüzdesinde %5'lik bir orana sahiplerdir.
Üç biyokimyasal yol kompleman sistemini etkinleştirir:
- Klasik Kompleman Yolu
- Alternatif Kompleman Yolu
- Mannoz Bağlayıcı Lektin Yolu [1]
Tarihçe
19. yüzyılın sonlarına doğru, kan serumunun bakterileri öldürebilme yeteneğinde bir faktörünün ya da presibinin olduğu bulundu. 1896'da genç bir Belçika'lı bilimadamı Jules Bordet Paris Pasteur Enstitüsünde bu prensibin iki bileşende analiz edildiğini yayımladı: bir sıcaklığı-sabit ve bir sıcaklığı-değişken bileşen. (Sıcaklığı-değişken, serum ısıtıldığındaa etkinliğin kaybeden demek.)
Sıcaklığı-sabit bileşen bağışıklık karşıtı özgül mikroorganizmalara sunulmuş bulunurken, sıcaklığı-değişken bileşen bütün normal serumca sunulan özgül-olmayan antimikrobiyal aktiviteden sorumlu bulundu. Sıcaklığı-değişken bileşen bizim şu an bahsettiğimiz kompleman yani "tamamlayıcı"ydı.
Kompleman (tamamlayıcı) terimi, Paul Ehrlich tarafından 1890'ların sonlarına doğru onun büyük bağışıklık sistemini teorisinin parçaları olarak ortaya çıktı. Bu teoriye göre, bağışıklık sistemi hücreleri yüzeylerinde antijenleri tanıyan özel reseptörler (almaçlar) taşımaktaydı. Antijenle bağışıklama sırasında bu reseptörlerin çoğu şekillenir ve dolaşan kana dökülürlerdi. Günümüzde "antikor"lar olarak isimlendirdiğimiz bu reseptörler Ehrlich tarafından bağlama kapasitelerinin her ikisini de (özgül antijeni tanır ve bağlanırlar, fakat ayrıca taze serumdaki sıcaklığı-değişken olan antimikrobiyal bileşene de bağlanırlar) vurgulamak için "amboseptörler" olarak adlandırılmıştı. Bu yüzden Ehrlich bu sıcaklığı-değişken bileşeni kompleman (tamamlayıcı) olarak nitelendirdi, çünkü bu; bağışıklık sisteminin hücreleri "tamamlayan", kanda bulunan bir şeydi.
Bordet tamamlayıcının sadece bir tipi olduğuna inanırken, Ehrlich her antijene-özgü amboseptörün kendine özgül tamamlayıcısı olduğuna inandı.
Bu tezatlık, 20. yüzyılın başlarında, komplemanın özgül antikorlarla kombinasyonlarda ya da özgül-olmayan yollarda rol oynayabileceğinin anlaşılmasıyla çözüldü.
Batı dillerinde kompleman sözcüğü tamamlayıcı anlamına geldiğinden, bu biyolojik sistemin adı da Türkçeye "kompleman sistemi" olarak girmiştir.
Bakış
Üç yolun hepsi de proteaz C3-konvertazın homolog şekillerini üretir. Alternatif ve mannoz-bağlayıcı lektin yolları C3 hidrolizis ya da antijenlerle antikorların sunumu (özgül-olmayan bağışıklık yanıtı) olmaksızın etkinleşebilirken, klasik kompleman sistemi etkinleşme için tipik olarak antikorlara ihtiyaç duyar.
Bu üç yolda da, bir C3-konvertaz C3a ve C3b yaparak ve daha sonraki ayrılma ve etkinleşme kaskadlarının başlamasına neden olacak şekilde bileşen C3'e ayrılır ve onu etkinleştirir.
C3b opsonizasyonla fagositlerlerce daha büyük internalizasyona öncülük eden patojenlerin yüzeyine bağlanır. C5a, yangıya hücrelerin toplanmasında yardımcı olan önemli bir kemokindir. C3a ve C5a'nın her ikisi de anaflatoksin etkisine sahiplerdir, damar geçirgenliğini ve düz kas yoğunluğunu arttırma kadar, mast hücrelerinin degranülasyonunu doğrudan tetiklerler. C5b, C5b'in C6, C7, C8 ve polimerik C9 içeren MAC ile sonuçlanan yüzey saldırı kompleksini başlatır.[2]
MAC, kompleman kaskadadın sitolitik son ürünüdür, hedef hücrenin ozmotik lizisine neden olan bir transmembran kanalı olarak şekillenir. Kupffer hücreleri ve diğer makrofaj hücre tipleri tamamlayıcı-kaplı patojenlerin temizlenmesine yardımcı olurlar. Doğuştan gelen bağışıklık sisteminin parçası olarak, kompleman kaskadın elementleri omurgalılardan daha ilkel canlılarda da bulunabilir, en yakın geçmişte ilkel atnalı yengeci türleri, sistemin önceleri düşünüldüğünden daha gerilerde olabildiğini göstermiştir.
Klasik kompleman yolu
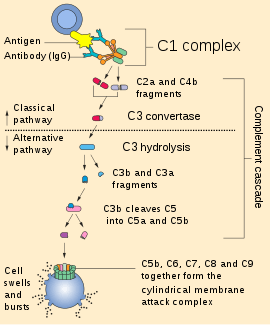
Klasik kompleman sistemi, C1 kompleksinin (bir C1q ve iki C1r ve C1s molekülü içerir) etkinleşmesiyle ve/veya C1q'nun M ve G sınıfından antijenlerle kompleks yapmış (IgM'nin bir molekülü yolu başlatmaya yeterlidir) antikorlara bağlanmasıyla tetiklenir. IgG (daha çok moleküle ihtiyaç duyması ya da C10 kompleksiyle doğrudan patojenin yüzeyine bağlanmasıyla) en az etkilidir. Bu bağlanma C1q molekülünde iki C1r (bir serin proteaz) molekülünün etkileştirilmesinde öncülük eden konformasyonal değişikliklere liderlik eder. Böylece bunlar C1s'e (başka bir serin proteaz) ayrılırlar. C1-kompleksi C4'ü bu halde bağlar ve daha sonra C2 (C2'yı üretir ve aslında C2b olarak adlandırılmalıdır çünkü "b"ler geleneksel olarak daha büyük parçalı ürünlerdir) ve C4'e ayrırır.
C1r ve C1s'nin uyarılması C1-inhibitörünce kontrol edilir. C4b ve C2a klasik yolu şekillendirmek için C3-konvertazla (lektin yolu etkinleştirilmesinde şekillenen C4b2a kompleksi, C3-konvertazın aynısıdır) bağlar. C3-konvertazın üretimi C3'ün C3a ve C3b'ye ayrılmasına öncülük eder; C3b; C2a'ya ve C4b'ye (C3 konvertaz) C5 konvertazı yapmak üzere katılır.
C3-konvertaz eritrosit membranlarını bir GPI çengeliyle bağlayan DAF (bozulma hızlandırma faktörü) ile bozulur.
Alternatif kompleman yolu
Alternatif kompleman yolu, patojenin yüzeyinde doğrudan bulunan C3 hidrolizis ile tetiklenir. Bu, diğer yollardaki patojen-bağlayıcı protein gibi güven vermez.[1] Alternatif kompleman yolunda, C3 proteini karaciğer tarafından üretilir ve kandaki enzimlerle C3a ve C3b'ye ayrılır. Eğer kanda hiç patojen yoksa, C3a ve C3b proteini parçaları etkinliklerini yitirir. Bununla beraber, eğer bir patojenin yakınlarındaysa, C3b'nin bazı parçaları patojenin plazma mambranına bağlanır. Bundan sonra kompleman faktör B bağlanacaktır. Bu kompleks faktör D ile Ba'ya ve alternatif yolla C3-konvertaz ile Bb'ye ayrılacaktır. Bundan sonra patojenin yüzeyini "kancalamış" C3bBb kompleksi bir elektrikli testere gibi rol alıp, patojendeki kancalı C3bBb sayısını olumlu etkileyecek olan kandaki C3'ün C3a ve C3b'ye hidrolizini katalizler. C3'ün hidrolizinden sonra, C3b kompleksi, C5'i C5a ve C5b'ye ayrılacak olan C3bBbC3b'ye karmaşıklaşır (dönüşür). C5a ve C3a'nın mast hücresi degranülasyonunu tetiklediği bilinir. C5b ile C6, C7, C8, ve C9 (C5b6789) kompleksi ayrıca MAC olarak bilinen hücre zarı arasında bulunan yüzey saldırı kompleksini şekillendirmek üzere karmaşıklaşır ve hücre lizisini başlatır.
Lektin yolu (MBL - MASP)
Lektin yolu, klasik yola homologdur fakat opsoninle mannoz-bağlayıcı lektin (MBL) ve fikolinler C1q yerinedir. MBL-ilişkili serin proteazları etkinleştiren, MASP-1 ve MASP-2 (ayrı ayrı C1r ve C1s'ye benzeyen), C4'ü C4a ve C4b'ye ve C2'yi C2a ve C2b'ye ayrıabilen mannoz-bağlayıcı lektinin patojenin yüzeyindeki mannoz artıklarına bağlanmasıyla bu yol etkinleştirilir.
C4b ve C2a o zaman birlikte C3-konvertazı şekillendirmek için klasik yolda olduğu gibi bağlar. Fikolinler MBL ile homologdur ve MASP aracılığıyla benzer fonksiyonlardadır. Omurgasızlarda edinilmiş bağışıklık sistemi olmaksızın, fikolinler genişletilmiş ve onların bağlama özgüllükleri patojene özgü olmayan molekülleri tanıma zayıflığını telafi etmek için çeşitlenmiştir.
Kompleman sisteminin düzenlenmesi
Kompleman sistemi aşırı derecede harap olmuş ev sahibinin dokularında etkilenleştirilmesiye oldukça düzenlenebilme potansiyeline sahiptir. Kompleman sistemi, daha fazla konsantrasyonlarda bulundukları kan plazmasından salınan kompleman kontrol proteinleri tarafından düzenlenir. Bazı kompleman kontrol proteinleri kompleman tarafından hedeflenen kendini-sunan hücrelerin yüzeylerinden salınırlar. Örneğin; yüzey salıdırı kompleksinin şekillenmesi sırasında C9 polimerizasyonun baskılayan CD59.
Hastalıklardaki rolü
Kompleman sisteminin bir bağışıklık bileşeni olarak Barraquer-Simons sendromu, astım, lupus erythematosus, glomerulonefrit, artritin çeşitli şekilleri, otoimmün kalp hastalıkları, multipl skleroz, enflamasyonlu bağırsak hastalığı ve iskemia-reperfusyon yaralanmaları gibi bazı hastalıklarda rol aldığı düşünülmektedir. Kompleman sistemi ayrıca gittikçe artarak Alzheimer gibi merkezi sinir sistemi hastalıklarıyla ve diğer nörodejeneratif şartlarla da ilişkilendirilmektedir. Terminal yolların yetmezlikleri, otoimmün hastalıklarda ve menejit gibi enfeksiyonların her ikisinde de Gram negatif bakterilere saldırmada rol alan C56789 kompleksinin rolüyle ilişkilidir. Kompleman sisteminin düzenleyicileri faktör H ve yüzey kofaktör proteinindeki mutasyonlar atipik hemolitik üremi sendromuyla ilişkilendirilmiştir. [3][4] Bundan başka yaygın olan faktör H'deki (Y402H) tek nükleotidli polimorfizim, yaygın göz hastalığı (yaşa bağlı maküler dejenerasyon) ile ilişkilendirilmiştir.[5] Bu bozuklukların hepsi günümüzde ev sahibinin yüzeylerindeki hatalı kompleman etkinleşmeyle ilişkilendirilmektedir.
Geçmiş araştırmalar HIV/AIDS sırasında kompleman sisteminin vücudu daha çok hasarladığı maniplasyonlarını öne sürmüştür.[6][7]
Ek resimler
 Klasik
Klasik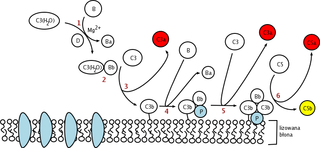 Alternatif
Alternatif
 Klasik
Klasik
Kaynaklar
- 1 2 Janeway CA Jr., Travers P, Walport M, Shlomchik MJ (2001). Immunobiology. (5th ed. bas.). Garland Publishing. (via NCBI Bookshelf) ISBN 0-8153-3642-X.
- ↑ Goldman AS, Prabhakar BS (1996). The Complement System. in: Baron's Medical Microbiology (Baron S et al, eds.) (4th ed. bas.). Univ of Texas Medical Branch. (via NCBI Bookshelf) ISBN 0-9631172-1-1.
- ↑ Dragon-Durey MA, Frémeaux-Bacchi V (2005). "Atypical haemolytic uraemic syndrome and mutations in complement regulator genes". Springer Semin. Immunopathol. 27 (3): 359–74. DOI:10.1007/s00281-005-0003-2. PMID 16189652.
- ↑ Zipfel PF, Misselwitz J, Licht C, Skerka C (2006). "The role of defective complement control in hemolytic uremic syndrome". Semin. Thromb. Hemost. 32 (2): 146–54. DOI:10.1055/s-2006-939770. PMID 16575689.
- ↑ Mooijaart SP, Koeijvoets KM, Sijbrands EJ, Daha MR, Westendorp RG (2007). Complement Factor H polymorphism Y402H associates with inflammation, visual acuity, and cardiovascular mortality in the elderly population at large. DOI:10.1016/j.exger.2007.08.001. PMID 17869048.
- ↑ Bolger MS, Ross DS, Jiang H, Frank MM, Ghio AJ, Schwartz DA, Wright JR, Complement Levels and Activity in the Normal and LPS-Injured Lung, American Journal of Physiology: Lung Cellular and Molecular Physiology. 2006 Oct 27; PMID 17071722
- ↑ Datta PK, Rappaport J, HIV and Complement: Hijacking an immune defence, Biomedicine and Pharmacotherapy, 2006 Nov; 60(9):561-568 PMID 16978830