Hidrojen sülfür
| Hidrojen sülfür | |
|---|---|
 | |
 | |
 | |
| Hidrojen sülfür[1] | |
| Diğer adlar Dihydrogen monosulfide Dihidrojen sülfür | |
| Tanımlayıcılar | |
| CAS numarası | 7783-06-4 |
| PubChem | 402 |
| EC numarası | 231-977-3 |
| UN numarası | 1053 |
| KEGG | C00283 |
| ChEBI | 16136 |
| RTECS numarası | MX1225000 |
| SMILES |
|
| InChI |
|
| Beilstein | 3535004 |
| Gmelin veritabanı | 303 |
| ChemSpider | 391 |
| 3DMet | B01206 |
| Özellikler | |
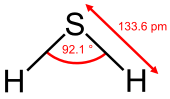
| Kimyasal formül | H2S |
| Molar kütle | 34,08 g mol−1 |
| Görünüm | Renksiz gaz |
| Koku | Çürük yumurta kokusu |
| Yoğunluk | 1.363 g dm−3 |
| Erime noktası |
−82 °C (−116 °F; 191 K) |
| Kaynama noktası |
−60 °C (−76 °F; 213 K) |
| Çözünürlük (su içinde) | 4 g dm−3 (20 °C) |
| Buhar basıncı | 1740 kPa (21 °C) |
| Asitlik (pKa) | 7.0[2][3] |
| Baziklik (pKb) | 12.9 |
| Tehlikeler | |
| R-ibareleri | R12, R26, R50 |
| NFPA 704 |
 4
4
0
|
| Parlama noktası | −82.4 °C (−116.3 °F; 190.8 K)[4] |
| Öztutuşma sıcaklığı |
232 °C (450 °F; 505 K) |
| Patlama sınırları | 4.3–46% |
| ABD maruz kalma limiti (PEL) |
C 20 ppm; 50 ppm [10-dakika maksimum zirve] |
| Belirtilmiş yerler dışında verilmiş olan veriler, standart haldedir. (25 °C, 100 kPa) | |
| Bilgikutusu kaynakları | |
Hidrojen sülfür, renksiz, çürük yumurta kokusunda zehirleyici bir gazdır. 1796'da C. Louis Berthallet tarafından bileşiği meydana getiren elementler tâyin edildi. Formülü H2S şeklindedir.
Çok şiddetli zehir olan hidrojen sülfürün 10-5lik bir konsantrasyonda da kokusu hissedilebilir. Sıvılaştırılmış hidrojen sülfür elektriği iletmez. Kaynama noktası -60,75 °C, erime noktası ise -83,70 °C'dir. Havadan 1.19 defâ daha ağırdır. Kaynama noktasında yoğunluğu 0,993'tür. Suda ve alkolde oldukça çözünür. Yanıcıdır. % 4,5-45,5 oranında hidrojen sülfür içeren hava patlayıcıdır.
Hidrojen sülfür az miktarda petrolde, kaplıcalarda ve tabiî gaz kuyularında bulunur. Elementlerinden de elde edilen hidrojen sülfür laboratuvarlarda demir sülfür üzerine hidrojen klorür etki ettirmekle elde edilir. Saf hidrojen sülfür elde etmek için kalsiyum veya baryum, sülfür reaksiyona sokularak oluşturulur.
2015 yılı Ağustos Ayında çok yüksek basınç altında (150 GPa (1.5 milyon atm)) hidrojen sülfürün −70 °C (203 °K)'de süper-iletkenlik gösterdiği keşfedildi.[5] Hidrojen sülfür bugüne kadar bulunmuş en yüksek Süperiletken dönüşüm sıcaklığına sahiptir.
Kaynakça
- ↑ "Hydrogen Sulfide - PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information. 19 Aralık 2013 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20131219042222/http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=402&loc=ec_rcs.
- ↑ Perrin, D.D. (1982). Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution (2nd bas.). Oxford: Pergamon Press.
- ↑ Bruckenstein, S.; Kolthoff, I.M., in Kolthoff, I.M.; Elving, P.J. Treatise on Analytical Chemistry, Vol. 1, pt. 1; Wiley, NY, 1959, pp. 432–433.
- ↑ "Hydrogen sulfide". npi.gov.au. 30 Mayıs 2013 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20130530213843/http://www.npi.gov.au/substances/hydrogen-sulfide/index.html.
- ↑ Cartlidge, Edwin (18 August 2015). "Superconductivity record sparks wave of follow-up physics". Nature News. Retrieved 18 August 2015.