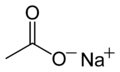
Sodyum asetat
| Sodyum asetat | |
|---|---|
 | |
| | |
| Sodyum asetat | |
| Sodyum etanat | |
| Diğer adlar Sıcak buz (Sodyum asetat trihidrat) | |
| Tanımlayıcılar | |
| CAS numarası | 6131‑90‑4 (trihidrat) 127‑09‑3 6131‑90‑4 (trihidrat) |
| PubChem | 517045 |
| EC numarası | 204-823-8 |
| ChEBI | 32954 |
| RTECS numarası | AJ4300010 (anhidrat) AJ4580000 |
| SMILES |
|
| InChI |
|
| ChemSpider | 29105 |
| Özellikler | |
| Kimyasal formül | C2H3NaO2 |
| Molar kütle | 82,03 g mol−1 |
| Görünüm | Beyaz toz |
| Koku | Bileşienlerine ayrılıncaya kadar ısıtıldığında sirke (asetik asit) kokusuna sahip olur.[1] |
| Yoğunluk | 1.528 g/cm3 (20 °C, anhidrat) 1.45 g/cm3 (20 °C, trihidrat)[2] |
| Erime noktası |
324 °C (615 °F; 597 K) (anhidrat) |
| Kaynama noktası |
881.4 °C (1,618.5 °F; 1,154.5 K) (anhidrat) |
| Çözünürlük (su içinde) | Anhidrat: 119 g/100 mL (0 °C) 123.3 g/100 mL (20 °C) 125.5 g/100 mL (30 °C) 137.2 g/100 mL (60 °C) 162.9 g/100 mL (100 °C) Trihidrat: 32.9 g/100 mL (-10 °C) 36.2 g/100 mL (0 °C) 46.4 g/100 mL (20 °C) 82 g/100 mL (50 °C)[3] |
| Asitlik (pKa) | 24 (20 °C) 4.76 CH3COOH |
| Baziklik (pKb) | 9.25 |
| Tehlikeler | |
| Ana tehlikeler | Tahriş edici |
| NFPA 704 |
 1
1
0
|
| Parlama noktası | >250 °C (482 °F; 523 K) |
| Öztutuşma sıcaklığı |
600 °C (1,112 °F; 873 K) |
| LD50 | 3530 mg/kg (oral, sıçan) |
| Belirtilmiş yerler dışında verilmiş olan veriler, standart haldedir. (25 °C, 100 kPa) | |
| Bilgikutusu kaynakları | |
Sodyum asetat (CH3COONa, aynı zamanda NaOAc şeklinde de ifade edilir.[4]), sodyum etonat olarak da bilinen asetik asitin sodyum tuzu. Isınarak sıvılaşabilen bu tuz, geniş bir kullanum alanına sahiptir.
Reaksiyonlar
Sodyum asetat bromoethan gibi alkil halidler ile birlikte ester oluştumak amacıyla kullanılabilir.
- CH3COONa + BrCH2CH3 → CH3COOCH2CH3 + NaBr
Sezyum tuzları reaksiyonu katalize eder.
Kaynakça
- ↑ "Sodium Acetate". International Chemical Safety Cards. National Institute of Occupational Safety and Health. 17 Mayıs 2016 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20160517034615/http://www.cdc.gov/niosh/ipcsneng/neng0565.html.
- ↑ http://chemister.ru/Database/properties-en.php?dbid=1&id=1510
- ↑ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand.
- ↑ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001).
This article is issued from Vikipedi - version of the 7/2/2016. The text is available under the Creative Commons Attribution/Share Alike but additional terms may apply for the media files.