Kimyasal reaktiflik
Kimyasal reaktiflik, bir reaksiyonun meydana gelme eğilimiyle ilişkilidir. Kimyasal tepkimelerin gerçekleşmesini belirleyen faktörler termodinamik düzeyinde incelenir. Termodinamik olarak bir reaksiyon eğer tepkimenin ürünleri reaktanlara kıyasla daha düşük serbest enerji düzeyinde ise gerçekleşir. Diğer taraftan Reaktiflik ise genel olarak bir maddenin kimyasal değişikliklere ya da kimyasal tepkimelere girme eğilimine denir. Elementlerin atomik yapısı ve elektronlarının dizilişi elementlerin ve oluşturdukları moleküllerin reaktifliğinde önemli rol oynar.[1] Soygazların örneğin kimyasal olarak çok az reaktiflik gösterdiği belirtilir.[2] Dolayısıyla kimyasal bileşik oluşturmaları zordur.[3] Bu durum soygazların tam dolu olan en dış elektron kabuğundan (valance kabuğu) dolayıdır.[4]
Kimyasal denge, asit ve baz kimyası, elektron transfer tepkimesi ve entropi gibi konular kimyasal reaktifliğin temel kavramlarıdır.
Kimyasal Reaktiflik-Temel Kavramlar
Kimyasal denge, asit ve baz kimyası, oksidasyon ve azaltma (indirgeme) tepkimeleri kimyasal reaktifliğin anlaşılmasında önem teşkil ederken, entropi, entalpi ve Gibbs serbest enerjisi gibi kavramlar bir kimyasal reaksiyonun gerçekleşme eğiliminin dolayısıyla kimyasal reaktiflik kavramının açıklanmasında belirleyici rol oynarlar.
Kimyasal Denge

Soldaki resim 6-methylpentacene ve 6-methylene-6,13-dihydropentacene arasında gerçekleşmiş olan kimyasal bir tepkimenin denge durumunu göstermektedir.
Kimyasal denge bir kimyasal reaksiyonda tepkimeye giren ve tepkime sonucu oluşan maddelerin konsantrasyonlarında yeterli bir zaman diliminde değişme olmadığı zaman oluşan durumu adlandırmak için kullanılır.[5] Eğer bu durum ileri tepkime ve geri tepkimenin hızlarının birbirine eşit olması sonucu gerçekleşiyorsa bu durum dinamik kimyasal denge olarak adlandırılır.[6]
Kimyasal denge genel olarak aşağıdaki gibi ifade edilebilir;
Burada ;
- a,b,c ve d katsayılar,
- A ve B reaktanlar,
- C ve D tepkime sonucu çıkan ürünler
- ve iki yönü de işaret eden ok da
tepkimenin iki yönde de ilerlediğini ifade etmek için kullanılmaktadır.
Sistemler kimyasal ya da fiziksel tabiyatlı olsun dengeye ulaşma eğilimi gösterirler. Hiçbir kimyasal reaksiyon kendiliğinden kimyasal dengeden uzaklaşma eğilimi gösteremez.[7] Dolayısıyla dengeye ulaşmış bir reaksiyonun devam edebilmesi için dışarıdan müdehale edilmeye ihtiyacı vardır.[8]
Kimyasal Denge Sabiti
Denge durumundaki kimyasal bir tepkime aşağıdaki gibi verilebir;
Termodinamik denge sabiti [9][10]
-
şeklinde tanımlanabilir
Gibbs serbest enerjisi bakımından denge sabiti;
şeklinde tanımlanır.
Asit ve Baz Kimyası
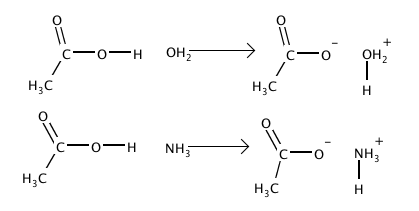
Asit baz reaksiyonu basitce bir asitle bir baz arasında gerçekleşen reaksionları adlandırmak için kullanılır. Bu reaksiyonların mekanizmaları göze alındığında birçok farklı tanımlama mevcuttur. Asit ve bazlarla ilgili ilk kapsamlı bilimsel tanımlama Fransız kimyager Antoine Lavoisier tarafından sağlanmıştır.[11]
Asit
- Çeşitli Asitler ve kimyasal Gösterim Şekilleri.
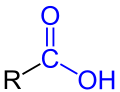 Genel Karboksil Asit Gösterimi
Genel Karboksil Asit Gösterimi Benzoik Asit
Benzoik Asit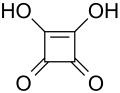 Kare Asit
Kare Asit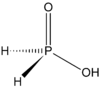 Hidrofosforik Asit
Hidrofosforik Asit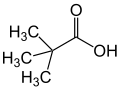 Pivalik Asit
Pivalik Asit
Asitin farklı şekillerde tanımlanması mümkündür. Bu tanımların bazıları;
- Arrhenius tanımına göre asit suda çözüldüğünde hidrojen iyonunun (H3O+)konsantrasyonunu artıran maddedir.[12]
- H2O(l) + H2O(l)
 H3O+(aq) + OH−(aq)
H3O+(aq) + OH−(aq)
- Bronsted-Lowry tanımına göre asit proton (H+) bırakan maddelere denir.[13]
- Lewis tanımına göre asit, H+ iyonu gibi, çözeltiden elektron eksilten maddelere denir.[14]
Asitlerin genel özellikleri şöyle sıralanabilir;
- Ekşimsi bir tada sahiptirler
- Bazlarla nötralizasyon reaksiyonuna girerler
- Aktif metallerle korrazyon reaksiyonuna girerler [15]
Baz
- Çeşitli Bazlar ve kimyasal Gösterim Şekilleri.
 Sodyum Hidroksid
Sodyum Hidroksid Ammonia
Ammonia Metilamin
Metilamin
Bazlarında asitler gibi farklı tanımları mevcuttur.
- Arrhenius Bazları suda çözüldüğünde OH- iyonlarının konsantrasyonunu artıran bileşiklere denilmektedir.
- NaOH(aq)Na(aq)++OH(aq)-
- Bronsted-Lowry tanımına göre bazlar çözeltiden proton azaltan moleküllerdir.
- HCl(aq)+NH3(aq)NH4++Cl-
Bu tanımlamaya göre hidroklorik asit (HCl) amonia (NH3)'ya bir proton verdiği için Bronsted-Lowry asidi diğer taraftan amonia ise proton eksiltiği için Bronsted-Lowry bazıdır.
- Lewis Teorisine göre ise bazlar electron veren maddelerdir. Diğer tanımlardan farklı olarak sadece elektron alışverişi üzerine kurulmuş bir tanımlamadır.[16]
- NH3+BF3H3NBF3
Bu reaksiyon ammonia ve boron trifluoride arasındadır. Hidrojen atomu transferi söz konusu olmadığından dolayı, bu örnek reaksiyon Lewis asit-baz reaksiyonudur.
Asit ve Baz Reaksiyonları

Asitlik bazlık değerine göre renk değişimi gözlemi
en sol asidik
Orta: nötral
Sağ Bazik
Hidroklorik asit ve sodyum hidroksit'in tepkimesi kuvvetli asit-baz reaksiyonlarına en temel örnektir. Öte yandan sitrik asit ve bikarbonate iyonu kimyasal tepkimesi zayıf asit-baz reaksiyonuna örnektir. Genel olarak 4 çeşit asit baz reaksiyonu vardır.
- a)Kuvvetli Asit Kuvvetli Baz reaksiyonu
- Kuvvetli asitle kuvvetli baz arasında gerçekleşen reaksiyondur. HCl ve NaOH sırasıyla kuvvetli asit ve bazdır dolayısıyla birlikte girecekleri tepkimede kuvvetli asit kuvvetli baz reaksiyonudur.[17]
- HCl(aq) + NaOH(aq) H2O(l) + NaCl(aq)
- HCl ve NaOH tümüyle iyonlaştıkları için yukarıdaki tepkime yeniden aşağıdaki gibi yazılabilir;
- H+(aq) + Cl-(aq) + Na+(aq) + OH-(aq) H2O(l) + Na+(aq) + Cl-(aq)
- b)Zayıf Asit Kuvvetli Baz reaksiyonu
- Zayıf bir asitle kuvvetli bir baz arasındaki tepkimedir. Zayıf asitler suda iyonlarına az miktarda çözünürler. Zayıf asit güçlü bazla tepkimeye girdiğinde zayıf asitten gelen H+ iyonu kuvvetli bazdan gelen OH- iyonuna transfer olur bunun sonucunda da su ve tuz oluşumu gerçekleşir. Bununla birlikte bu tepkimelerden oluşan tuz genellikle suda çözünebilme özelliğine sahiptir.
- HCO2H(aq) + OH-(aq) H2O(ℓ) + HCO2-(aq)
- c)Kuvvetli Asit Zayıf Baz reaksiyonu
- Kuvvetli asit zayıf baz reaksiyonuna HCl ve NH3'ün tepkimesi verilebilinir.
- H3O+(aq) + N3(aq) (aq) H2O(ℓ) + NH4+(aq)
- d)Zayıf Asit Zayıf Baz reaksiyonu
- Asetik asit ve ammonia'nın reaksiyonu buna örnektir.
- CH3CO2H(aq) + NH3(aq) NH4+(aq)+CH3CO2-
Entropi

Entropi bir sistemin ısı enerjisini mekanik enerjiye dönüştürememesine yetkinliğinin bir ölçüsüdür, sıklıkla bir sistemin düzensizliğinin ve raslantısallığının derecesi olarak da algılanmaktadır.[18] Bir kimyasal reaksiyonun gerçekleşmesinde entropi entalpi ile belirleyicidir.[19] Genel olarak gerçekleşmesi durumunda bir tepkime eğer sistemin entropisini artıracak yöndeyse o tepkime gerçekleşmeye eğilimlidir denir. Diğer taraftan gerçekleşmesi durumunda bir tepkime eğer egzotermik ise diğer bir deyişle entalpi azalırsa o tepkime gerçekleşmeye eğilimlidir denir.[20] Sıcak bir metal soğuk su içine konulduğunda soğumaya başlamasının kendiliğinden (sisteme dış bir müdehale yapılmadan) gerçekleşmesi entalpi eğilimli fiziksel tepkimeye örnektir. Entropi eğilimli tepkimelere ise aşağıdaki örnekler verilebilir;
- Maddenin katı halden sıvı hale geçmesi
- Gazların daha geniş bir hacime yayılması
- Mol sayısını artıran kimyasal reaksiyonlar
Bu örneklerin hepsinde entropide artış gözlenir. Entropi "S" harfi ile gösterilir. Bir kimyasal tepkimenin entropisindeki değişiklik;
- ΔrS° = ΣnS°(ürünler) − ΣnS°(reactants)
formülü ile ifade edilir. Bir reaksiyonun kendiliğinden gelişebilmesi için sistemin ve çevresinin entropisinin toplamında artış gözlenmesi gerekmektedir (Termodinamiğin 2. kanunu).[21] Aşağıdaki gibi ifade edilir;
- ΔS°(evren) = ΔS°(sistem) + ΔS°(çevre)
| Entalpi (ΔH°) | Entropi (ΔS°) | Kendiliğinden gerçekleşmesi |
|---|---|---|
| Egzotermik | >0 | ΔS°(evren) > 0 (her koşulda gerçekleşir) |
| Egzotermik | <0 | ΔS° ve ΔH° in farkına bağlıdır (düşük sicaklıklarda gerçekleşir). |
| Endotermik | <0 | ΔS°(evren) < 0. (Kendiliğinden gerçekleşemez). |
Gibbs Enerjisi

Gibbs serbest enerjisi 1870'li yıllarda Josiah Willard Gibbs tarafından bir sürecin sabit bir basınç ve sıcaklık koşullarında kendiliğinden gerçekleşip gerçekleşemeyeceğini tahmin etmek amacıyla tanımlanmıştır.[22] Gibbs enerjisi(G) iş yapabilme enerjisine dönüşebilecek kimyasal reaksiyon enerjisiyle ilgilidir. Bir sistemin Gibbs enerjisi sistemin entalpisi(H), sistemin entropisi(S) ve sicaklığının (T) bir işlevidir.[23] Matematiksel olarak Gibbs enerjisi aşağıdaki gibi ifade edilir;
- G=H-TS
Gibbs enerjisindeki değişim;
- ΔG = ΔH − TΔS
Standart koşullarda Gibbs enerjisindeki değişim;
- ΔG° = ΔH° − TΔS°
eşitliğiyle ifade edilir.[24] Bir reaksiyonun Gibbs enerjisi;
- ΔrG°
şeklinde ifade edilir.
Gibbs serbest enerjisi entropi ve entalpinin bir fonksiyonu olduğundan dolayı bir reaksiyonun kendiliğinden gelişip gelişemeyeceği hakkında bilgi içerir. Eğer bir reaksiyonun Gibbs serbest enerjisi < 0 ise o reaksiyon kendiliğinden gerçekleşir. Diğer taraftan eğer tepkimenin Gibbs serbest enerjisi sıfırdan büyük ise o reaksiyonun gerçekleşmesi için dış müdehale gereklidir. Gibbs serbest enerjisinin sıfıra eşit olduğu durum ise kimyasal denge durumunu belirtmektedir.
| ΔrG° | Kendiliğinden gerçekleşmesi |
|---|---|
| ΔrG° < 0 | Reaksiyon kendiliğinden gerçekleşir (standard koşullarda) |
| ΔrG° = 0 | Reaksiyon dengededir (standard koşullarda) |
| ΔrG° > 0 | Reaksiyon kendiliğinden gerçekleşmez (standard koşullarda) |
Elektron Transfer Reaksiyonları
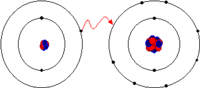
Bir bakır parçasının gümüş nitrat sulu çözeltisine eklendiğinde meydana gelen reaksiyon elektron transfer reaksiyonlarına basit bir örnektir. Bu örnekte oluşan reaksiyon
- Cu(s) + 2 Ag+(aq) → Cu2+(aq) + 2 Ag(s)
şeklinde ifade edilir. Bakır(Cu)'dan gelen elektronların gümüş(Ag)'e geçmesiyle elektron transfer reaksiyonu gerçekleşmiş olur. Bakır ve gümüş iyonları direk temas halinde olduklarında bu reaksiyon sonucu ısı üretilir. Eğer doğrudan değilde basit bir elektirik devresi vasıtasıyla temas halinde olurlarsa elektron transferi reaksiyonu neticesinde elektrik üretilmiş olur. Bu çeşit kendiliğinden gelişen kimyasal tepkimelerden oluşan enerjiyi elektrik üretmede kullanan aletlere Galvanik ya da Voltaik cell denir.[25]
Oksidasyon-Azaltma (Redoks) Reaksiyonu
Redoks reaksiyonları ya da oksidasyon-azalma tepkimeleri asit-baz reaksiyonlarına benzemektedir, ve temelde bir elektron transfer reaksiyonudur. Oksidasyon ve azaltma reaksiyonu birlikte gerçekleşir. Oksidasyon elektron kaybını, diğer taraftan azaltma elektron kazanımını ifade etmektedir.[26] Tüm elektron transfer tepkimelerinin genel özellikleri
- Bir reaktan okside olur, bir reaktant azaltılır,
- Oksidasyon ve azaltma dengede bir şekilde ilerlemek zorundadır,
- Okside eden madde azalır,
- Azaltan madde okside olur
şeklinde sıralanabilinir.
- Cu(s)+2Ag+(aq)→ Cu2+(aq)+2 Ag(s)
Reaksiyonunda Cu okside olmuştur dolayısıyla azaltan maddedir. Diğer taraftan Ag azaltılmıştır dolayısıyla okside edici maddedir.
Ayrıca bakınız
- Kimya
- Termodinamik
- Kimyasal tepkime
- Redoks
- Oksidasyon
- Asit baz tepkimeleri
- Entropi
- Entalpi
- Gibbs Serbest Enerjisi
- Lewis teorisi
- Michaelis–Menten kinetiği
- Kimyasal kinetik
Dış Kaynaklar
- Kimyasal Reaktiflik (İngilizce)
- Reaksiyon Mekanizması (İngilizce)
- Kimyasal Denge (İngilizce)
- Kimyasal Denge
- Asit Baz Teorisi
- Entropi ve Entalpi
Kaynakça
- Townsend, John C. Kotz, Paul M. Treichel, John R.. Chemistry & chemical reactivity (8th ed. bas.). Belmont, CA: Brooks/Cole, Cengage Learning. ISBN 0-8400-48289.
- [et (2010) al.], Ralph H. Petrucci ... . General chemistry : principles and modern applications (10th ed. bas.). Toronto: Pearson Prentice Hall. ISBN 978-0-13-206452-1.
- Paula, Peter Atkins, Julio de (2002). Atkins' physical chemistry (7th ed. bas.). New York: Oxford University Press. ISBN 9780198792857.
- Chipinda, I; Hettick, JM; Siegel, PD (2011). "Haptenation: chemical reactivity and protein binding.". Journal of allergy 2011: 839682. PMID 21785613
- Türker, Lemi (1 Ocak 2012). "A Model Study on the Possible Effects of an External Electrical Field on Enzymes Having Dinuclear Iron Cluster [2Fe-2S]". The Scientific World Journal 2012: 1–9. doi:10.1100/2012/985958
- Klopman, Gilles. (1 Ocak 1968). "Chemical reactivity and the concept of charge- and frontier-controlled reactions". Journal of the American Chemical Society 90 (2): 223–234. doi:10.1021/ja01004a002.
Dipnotlar
- ↑ "Reactivity and Atomic Structure". chem.ucla.edu. 16 Haziran 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150616115131/http://www.chem.ucla.edu:80/harding/notes/notes_14C_str&react.pdf. Erişim tarihi: 23 Kasım 2012.
- ↑ "Noble Gases". chemicalelements.com. 2 Temmuz 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150702100602/http://www.chemicalelements.com:80/groups/noblegases.html. Erişim tarihi: 23 Kasım 2012.
- ↑ "Noble Gases". britannica.com/. 30 Nisan 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150430021654/http://www.britannica.com:80/EBchecked/topic/416955/noble-gas. Erişim tarihi: 23 Kasım 2012.
- ↑ "Group 18". chemwiki.ucdavis.edu. 21 Nisan 2014 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20140421170359/http://chemwiki.ucdavis.edu:80/Inorganic_Chemistry/Descriptive_Chemistry/Main_Group_Elements/Group_18:_The_Noble_Gases. Erişim tarihi: 23 Kasım 2012.
- ↑ "Chemical Equilibria". pages.towson.edu/. 2 Mayıs 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150502120957/http://pages.towson.edu:80/ladon/chemeq.html. Erişim tarihi: 23 Kasım 2012.
- ↑ "Dynamic Equilibrium". chemwiki.ucdavis.edu. 29 Temmuz 2013 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20130729041724/http://chemwiki.ucdavis.edu:80/Physical_Chemistry/Chemical_Equilibrium/Principles_of_Chemical_Equilibria/Dynamic_equilibrium. Erişim tarihi: 23 Kasım 2012.
- ↑ "Chemical Eq.". learnquebec.ca/. 25 Kasım 2010 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20101125181608/http://learnquebec.ca/export/sites/learn/en/content/curriculum/mst/documents/c534c06.pdf. Erişim tarihi: 24 Kasım 2012.
- ↑ "Chemical Equilibrium". 3 Mayıs 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150503231409/http://hyperphysics.phy-astr.gsu.edu:80/hbase/chemical/chemequi.html. Erişim tarihi: 24 Kasım 2012.
- ↑ F.J,C. Rossotti and H. Rossotti, The Determination of Stability Constants, McGraw-Hill, 1961. p. 5
- ↑ IUPAC Green Book, 3rd edition, p58 pdf
- ↑ Miessler, G.L., Tarr, D. A., "Inorganic Chemistry" (1991) p. 166
- ↑ "Acid". intro.chem.okstate.edu. 3 Mayıs 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150503185559/http://intro.chem.okstate.edu:80/1225/Lecture/Chapter17/Lec4999.html. Erişim tarihi: 23 Kasım 2012.
- ↑ "Asit". files.chem.vt.edu/. 22 Şubat 2014 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20140222212720/http://www.files.chem.vt.edu:80/chem-ed/courses/equil/acidbase/aciddefn.html. Erişim tarihi: 23 Kasım 2012.
- ↑ "Lewis". /chemed.chem.purdue.edu/. 6 Temmuz 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150706145212/http://chemed.chem.purdue.edu:80/genchem/topicreview/bp/ch11/lewis.php. Erişim tarihi: 23 Kasım 2012.
- ↑ "Acid". .chemtutor.com. 13 Ağustos 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150813133447/http://chemtutor.com/acid.htm. Erişim tarihi: 24 Kasım 2012.
- ↑ "Acids_and_Bases". chemwiki.ucdavis.edu. 3 Ocak 2016 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20160103184156/http://chemwiki.ucdavis.edu/Physical_Chemistry/Acids_and_Bases/Acid?highlight=acid. Erişim tarihi: 23 Kasım 2012.
- ↑ "Tiltration". chemwiki.ucdavis.edu. 23 Haziran 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150623014005/http://chemwiki.ucdavis.edu:80/Analytical_Chemistry/Quantitative_Analysis/Titration/Titration_Of_A_Strong_Acid_With_A_Strong_Base. Erişim tarihi: 23 Kasım 2012.
- ↑ "Entropy". oxforddictionaries.com. 27 Haziran 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150627143916/http://www.oxforddictionaries.com:80/definition/english/entropy?. Erişim tarihi: 23 Kasım 2012.
- ↑ "Reactivity". employees.csbsju.edu. 3 Temmuz 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150703113142/http://employees.csbsju.edu:80/cschaller/Reactivity/thermo/TDfreeNRG.htm. Erişim tarihi: 23 Kasım 2012.
- ↑ "Enthalpy". faculty.ncc.edu. 5 Şubat 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150205020032/http://faculty.ncc.edu:80/LinkClick.aspx?fileticket=Og3LnK0N-Qg%3D&tabid=1937. Erişim tarihi: 23 Kasım 2012.
- ↑ "2nd law". Nasa. 22 Haziran 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150622160650/http://www.grc.nasa.gov:80/WWW/K-12/airplane/thermo2.html. Erişim tarihi: 23 Kasım 2012.
- ↑ "gibbs-free-energy". 7 Eylül 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150907165245/http://chemistry.about.com/od/chemistryglossary/g/gibbs-free-energy-definition.htm. Erişim tarihi: 24 Kasım 2012.
- ↑ "Gibbs Free Energy". hyperphysics.phy-astr.gsu.edu. 18 Mayıs 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150518015305/http://hyperphysics.phy-astr.gsu.edu:80/Hbase/thermo/helmholtz.html. Erişim tarihi: 24 Kasım 2012.
- ↑ "Gibbs Free Energy". chem.tamu.edu. 9 Mayıs 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150509141753/http://www.chem.tamu.edu:80/class/majors/tutorialnotefiles/gibbs.htm. Erişim tarihi: 24 Kasım 2012.
- ↑ "Galvanic-Cells". chemed.chem.wisc.edu. 26 Ocak 2013 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20130126184707/http://chemed.chem.wisc.edu/chempaths/GenChem-Textbook/Galvanic-Cells-699.html. Erişim tarihi: 24 Kasım 2012.
- ↑ "Redox Reaction". shodor.org. 29 Haziran 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20150629025713/http://www.shodor.org:80/UNChem/advanced/redox/index.html. Erişim tarihi: 24 Kasım 2012.
| ||||||