Rahim ağzı kanseri
| Rahim ağzı kanseri | |
|---|---|
|
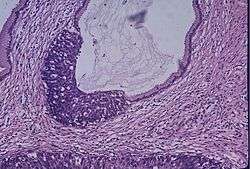
Servikal intraepitelyal neoplazinin (CIN2) H&E boyamada histopatolojik görüntüsü | |
| Sınıflandırma ve dış kaynaklar | |
| Uzmanlık | Onkoloji |
| ICD-10 | C |
| ICD-9 | 180 |
| OMIM | 603956 |
| Hastalık Veri Tabanı | 2278 |
| MedlinePlus | 000893 |
| eMedicine | med/324 radio/140 |
| MeSH | D002583 |
Serviks kanseri, servikal kanser ya da rahim ağzı kanseri, rahim ağzının (servikal alanın) habis (kötücül) kanseridir. Serviks kanseri, epitelden köken alan habis tümör, yani karsinomdur. İlk belirtisi vajinal kanama olabilir, ama iyice ilerleyene kadar bir belirti göstermeme durumu da söz konusudur. Tedavisi, erken evrelerde ameliyat, ileri aşamalarda kemoterapi ve radyoterapidir.
Serviks kanseri; dünya üzerinde her 2 dakikada bir kadının ölümüne neden olan ve değişik ülkelerde yapılan çalışmalarda kadınlarda meme kanserinden sonra en sık görülen ikinci kanserdir[1].
"Papanicolaou smear" (PAP smear) testi ile serviks kanseri oluşumu öncesi değişikliklerin tanınması mümkün olmaktadır. Serviks tarama çalışmalarının rutin olarak kullanıldığı ülkelerde invaziv serviks kanseri oranı %50'den fazla azalmıştır.
Epidemiyolojik çalışmalar serviks kanseri için majör risk faktörünün insan papilloma virüs (Human Papilloma Virus 'den kısaltma HPV olarak anılır) enfeksiyonu olduğunu göstermektedir. Serviks kanseri - HPV enfeksiyonu ilişkisi, akciğer kanseri - sigara ilişkisinden daha sıkı bir ilişkidir[2]. Serviks kanser vakalarının hemen hepsinin (%99,7) gelişmesinde HPV enfeksiyonunun gerek şart olduğu bulunmuştur[2][3]. Morbidite ve mortalite oranları çok yüksek olan bu kanserden korunmada HPV aşısının geliştirilmiş olması büyük öneme haizdir. Serviks kanserinin %70'ine[4] neden olan iki HPV suşuna karşı geliştirilmiş bir aşı, AB ve ABD pazarları için lisanslanmıştır[5]. Bu aşı, sadece en sık görülen virüs tiplerine karşı etkili olduğu için, aşılanan kadınların PAP smear taramasına devam etmeleri önerilmektedir[6].
Sıklık ve yaygınlık
Halk arasında rahim ağzı kanseri olarak bilinen serviks kanseri, dünya üzerinde her 2 dakikada bir kadının ölümüne neden olan ve değişik ülkelerde yapılan çalışmalarda kadınlarda meme kanserinden sonra en sık görülen ikinci kanserdir[1]. Avrupa'da her yıl 50 bin, dünyada ise 500 bin kadına serviks kanseri tanısı konmakta, Avrupa'da yılda 25 bin, dünyada da 250 bin kadın bu nedenle ölmektedir[7]. Gelişmiş ülkelerde kadın kanserlerinin %3,6'sını, gelişmemiş ülkelerde kadın kanserlerinin %15'ini oluşturur[1]. ABD ve Birleşik Krallık'taki serviks kanseri sıklığının dünya çapındaki sıklığının yarısı kadar olması[8] PAP smear taramasının başarısına atfedilmektedir.[9].
Türkiye'ye ait geniş bir veri tabanı olmamasına rağmen 2002 verilerinde Dünya kanser veri tabanına (Globocan) göre kadınlarda ölüme sebep olan 7. kanser olduğu görünmektedir[8]. 1999 yılı T.C. Sağlık Bakanlığı istatistiklerine göre Türkiye'de genel kanser insidansı 100.000'de 30,38; meme kanseri insidansı 7,32 iken, serviks kanseri 0,95'dir ve sıklık sıralamasında 7. sıradadır[1]. Türkiye'de en güvenilir kanser istatistiklerinin tutulduğu İzmir ilinde 1993-1994 yıllarında yapılan bir değerlendirmede serviks kanseri; meme kanseri ve kolorektal kanserlerden sonra 3. en sık kanser, insidansı da 100.000'de 5,4 olarak belirlenmiştir.[10]. Türkiye'de servikal kanserin diğer ülkelere göre daha az görülmesi, bildirim sisteminin ve sağlık hizmetlerine erişimin yetersizliğine atfedilmiştir[11].
Risk faktörleri
Serviks kanseri için birçok risk faktörü tanımlansa da, son epidemiyolojik çalışmalar bu kanser türü için majör risk faktörünün HPV (insan papilloma virüs) enfeksiyonu olduğunu göstermektedir. Serviks kanseri olgularının neredeyse tümünde HPV enfeksiyonu olduğu gösterilmiştir. Bununla beraber kanser gelişimini tetikleyen başka risk faktörleri de mevcuttur. Bu risk faktörleri: erken yaşta cinsel ilişki (20 yaştan önce), çok sayıda cinsel eş, eşin çok eşli olması (erkeğin başka eşlerinin olması), yüksek parite (doğum sayısının fazlalığı), kötü hijyen, düşük sosyoekonomik seviye, pozitif aile öyküsü (aile (kan bağı olan) fertlerinde servikal kanser tanısı konmuş olması), sigara kullanımı, yetersiz beslenme (bilhassa; vitamin C, vitamin A, beta karoten ve folat eksikliği), klamidya trachomatis enfeksiyonu ve cinsel yolla bulaşan diğer bazı ajanlardır. Bunlara ek olarak eskiden risk faktörü olarak kabul gören, uzun süreli oral kontraseptif (doğum kontrol hapı) kullanımı ve Herpes simpleks virüs tip II enfeksiyonu günümüzde artık risk etkeni olarak kabul edilmemektedir[12][13][14][15][16].
Risk faktörleri arasında özellikle paritenin önemi yaklaşık 150 yıldır bilinmekte olup cinsel temasa ve buna bağlı faktörlere araştırmacıların dikkatini çekmiştir. Bu nedenle birçok cinsel yolla bulaşan hastalık ve virüsler araştırılmıştır. 1970'li yıllarla beraber HPV üzerinde çalışmalar başlamış ve pozitif bulgularla beraber günümüzde önemli bir bilgi birikimi elde edilmiştir. Bugün serviks kanseri gelişimi için HPV'nin mutlaka var olması gerektiği, diğer risk faktörlerinin ya virüsle karşılaşma oranlarını arttırdığı ya da viral persistansı-karsinojenik süreci hızlandırdığı için önemli olduğu üzerinde durulmaktadır[17].
HPV enfeksiyonu
Epidemiyolojik çalışmalar serviks kanseri için majör risk faktörünün HPV (insan papilloma virüs) enfeksiyonu olduğunu göstermektedir. Serviks kanseri-HPV enfeksiyonu ilişkisi, akciğer kanseri-sigara ilişkisinden daha sıkı bir ilişkidir. Diğer taraftan HPV enfeksiyonu son derece yaygın bir enfeksiyondur. Amerika Birleşik Devletleri Hastalık Kontrol Merkezi (CDC) verilerine göre dünyada seksüel aktif kadın ve erkeklerin yaşam boyu HPV ile enfekte olma olasılığı en az %50 olarak bildirilmiştir. Serviks kanseri olgularının neredeyse tümünde (%99,7) HPV DNA izole edilir[2]. Bununla beraber serviksteki HPV enfeksiyonlarının çoğu asemptomatiktir ve saptanan enfeksiyonlarının %90'dan fazlası 2 yıl içeresinde kendiliğinden yok olabilmektedir[18]. Dolayısıyla serviks kanseri sıklığında azalma HPV enfeksiyonlarının tanınması, önlenmesi ve tedavi edilmesi yoluyla mümkün olabilir[2].
_EM.jpg)
Servikal kanser genellikle HPV'nin onkojenik tiplerinin uzun süren enfeksiyonu sonucu ortaya çıkar. Şimdiye dek 100'den fazla HPV tipi saptanmıştır; bunlardan onkojenik türler, servikal kansere ya da vulvar prekanseröz lezyonlara neden olmaktadır. Cinsel açıdan aktif her kadın servikal kanser riski taşır. Kadınların yüzde elli veya sekseni HPV enfeksiyonuna yakalanır; bunların %50'si onkojenik HPV iledir. HPV enfeksiyonlarının birçoğu immun sistem tarafından başedilir ama, onkojenik HPV tiplerinin neden olduğu enfeksiyon geçmezse servikal kanser gelişebilir[19].
Serviks kanseri oluşturma riski açısından HPV genotipleri düşük ve yüksek riskli olmak üzere ikiye ayrılmaktadır. Yüksek riskliler; 16, 18, 31 ve 45 başta olmak üzere 33, 39, 51, 52, 56, 58, 59, ve 68 tipleridir[20]. Bununla beraber serviks kanseri oluşturma açısından en fazla riski HPV 16 suşunun taşıdığı bilinmektedir[18]. Yaş ve cinsiyete bağlı olarak HPV 16 suşunun seroprevalansı kadınlarda 20-29 ve 40-49 yaş grupları arasında pik yaparken; erkeklerde 30-39 yaşları arasında pik yapmaktır. İki cinsiyette de 12-19 yaş grubunda seropozivite oldukça düşüktür[21].
Servikal kansere neden olan HPV tipleri bölgesel değişiklikler göstermekle birlikte olguların %70-80'inden HPV-16 ve HPV-18 sorumludur. HPV-16 ve HPV-18'in oranları sırasıyla; Kuzey Amerika ve Avrupa'da %69,7 ve %14,6; Orta ve Güney Amerika'da %57 ve %12,6; Kuzey Afrika'da %67,6 ve %17; Güney Asya'da %52,5 ve %25,7 olarak bildirilmektedir. Türkiye'de HPV tipleri ve neden olduğu hastalıklar konusunda yeterli veri bulunmamaktadır[1].
HPV enfeksiyonu, başka geçiş yolları olsa da, daha çok cinsel ilişki yoluyla geçer. Türkiye'de kullanılma oranı yüksek olmayan kondom ve bariyer önlemleri, HPV enfeksiyonu riskini azaltır, ancak bu tam olarak koruyucu değildir. Daha çok genç yetişkinlerde görülen bu hastalığın cinsel yaşam tarzında ortaya çıkan değişikliklere bağlı olarak son yıllarda arttığı görülmektedir[1][22][23].
Tarama testleri
Serviks kanserinin yavaş doğal seyri, displastik lezyonların erken tanınmasında ve invaziv kansere progresyonun önlenmesinde tarama programlarının önemini ortaya koymaktadır. Hastalığın hafif displazi ile başlayıp invaziv karsinoma doğru devamlılık gösterdiğinin kanıtı servikal displazinin 20'li yaşlarda, karsinoma in situnun 25-35’li yaşlarda ve invaziv hastalığın 40 yaşından sonra görülmesidir. Bu yüzden, invaziv kanser aşamasına gelmeden önce lezyonları yakalamak için taramaya erken yaşlarda başlanılmalıdır[13][14].

Çoğu kanserde olduğu gibi serviks kanserinde de erken tanının yaşam süresi ile yakın ilişkisi vardır. Preinvazif olgularda 5 yıllık yaşam %100 olurken; bu değer erken lokalize tümörlerde %92, lokal yayılım durumunda %49, uzak metastaz durumunda ise %15 dolayındadır[7].
Bunlar arasında uzun zamandan beri başarı ile uygulanmakta olan Papanicolaou smear (PAP smear) testi ile elde edilen materyalin servikal yayma yöntemi ile tarama çalışmalarının büyük önemi vardır. 1943'de Papanicolaou ve Traut'un yayınladığı uterus kanserlerinin vaginal smear ile tanısı konusundaki çalışmasından sonra, servikal lezyonların preinvazif (in situ) evrede saptanmasıyla serviks kanserinden ölüm oranları %50-70 azalmıştır[15].
Günümüzde servikal kanserlerin taranmasında kullanılan en yaygın yöntem Papanicolou Smear (PAP smear) tarama testidir. PAP smear testi, ucuz ve kolay olması, hastalar tarafından kolay kabul edilebilmesi ve toplumsal taramalarda kullanılarak serviks kanserinden ölümleri yaklaşık %75 oranında düşürebilmesi ile eşsiz bir tarama yöntemidir. Buna rağmen serviks kanserlerinin %50'den fazlasının daha önce hiç PAP smear testi yaptırmamış ve %60'tan fazlasının da son 5 yıl içinde hiç tarama yaptırmamış kadınlarda olduğunu gösteren çalışmalar vardır[24].
Pap smear ile servikal kanser taraması, kanser önlenmesine yönelik ve maliyet açısından etkin olan çok nadir metodlardan birisidir. Servikal kanser, etiyopatogenezi açısından belirli prekanseröz aşamalardan geçtikten sonra belirli bir süre sonunda invaziv lezyon haline gelmektedir. Bu nedenle servikal kanserlerin premalign aşamada yakalanması ve tedavi edilmesi, insidans ve mortaliteyi düşürecektir[25].
Servikal kanserin erken teşhisine yönelik PAP smear taramasıyla ilgili olarak American Cancer Society (ACS), kadınların ilk seksüel deneyimden 3 yıl sonra veya seksüel aktif olsun ya da olmasın 21 yaşına geldiklerinde, 30 yaş ve üzerinde her yıl, üç yıl negatif sonuç çıkması durumunda 3 yılda bir PAP smear testi yaptırmalarını, 70 yaşın üzerinde ve son 10 yılda anormal PAP test sonucu olmayan, üç veya daha fazla normal PAP test sonucu olan kadınların servikal kanser tarama programından çıkarılmalarını bildirmiş; benzer şekilde American College of Obstetricians and Gynecologist (ACOG), hayatı boyunca herhangi bir dönemde veya halen seksüel aktif olan ya da 21 yaşına gelmiş tüm kadınların yıllık pelvik muayene ve PAP smear yaptırmalarını, 30 yaş üzerinde ve 3 yıl ardışık yıllık normal pelvik muayene ve PAP smear sonucu olan kadınların daha uzun aralıklarla kontrol edilebileceğini bildirmiştir[25].
Sitoloji

Servikal patolojileri taramada sitoloji halen ilk sırada gelmektedir. 1988'de Bethesda sistemi geliştirilmiştir. Bu sistem 1991, 2000, 2001 tarihinde yeniden modifiye edilmiştir. Günümüzde Bethesda Sınıflaması kullanılmaktadır[14][26][27][28].
Günümüzde başlıca iki sitolojik yöntem kullanılmaktadır: geleneksel PAP smear ve sıvı bazlı preparatlar (ThinPrep, SurePath). Genel olarak servikal kanserin tarama yöntemi olarak Pap smear tercih edilir. Son çalışmalara göre, duyarlılığının (sensitivitesinin) %50'lerde olduğunu gösterilmiştir[29][30][31][32]. Sıvı bazlı ve bilgisayarlı tarama gibi yeni sitolojik teknikler %70'e varan daha yüksek duyarlılığa sahiptirler. Fakat ne yazık ki; bu teknikler gelişmekte olan ülkelerde sıklıkla kullanılamamaktadır. Düşük duyarlılığına karşın, Pap smear'in spesifitesi (özgüllük) (%94) oldukça yüksektir[14][29][32][33][34].
Sıvı bazlı sitoloji, konvansiyonel smear'e göre, intraepitelyal (epitel içi) lezyonları saptamada daha duyarlıdır. Yüksek dereceli lezyonlar için konvansiyonel Pap smear %70, sıvı bazlı sitoloji %95; HPV testiyle kombine sıvı bazlı sitoloji ise %100 duyarlıdır[14][35][36][37].
Nümunenin yeterli sayılması için, likit bazlı sitolojik incelemede en az 5.000, konvansiyonel smearde 8.000-12.000 iyi izlenen skuamöz hücrelerin varlığı gerekir. Metaplastik ve endoservikal hücrelerin varlığı, transformasyon bölgesinin yeterli örneklendiğini gösterir. Eğer enflamasyon, kan ya da döküntü (debris) nedeniyle hücrelerin %75'ten fazlasının yorumlanamazsa nümune yetersiz sayılır. Yetersiz smear varlığında mutlaka iki-dört ay içinde smear tekrarlanmalıdır. Enfeksiyon varlığında enfeksiyon tedavi edilmelidir. Tekrarlayan smear yine yetersiz ise, kolposkopi ve/veya biyopsi yapılması uygundur[14][27][29].
Servikografi
Serviksin seyreltilmiş asetik asit uygulandıktan sonra, özel bir kamera (servikoskop) aracılığı ile görüntülenmesidir. Duyarlılığı %50, özgüllüğü %88'dir[33]. Düşük dereceli lezyonlar için daha duyarlıdır[14][38].
Asetik Asit Testi
Asetik Asit Testi, asetik asit uygulanmasından sonra serviksin çıplak gözle incelenmesidir. Beyaz alan görülmesi pozitif test sonucunu vermektedir[39]. Sensitivitesi %70-80'lerde fakat; spesifitesi (%50-70) düşüktür[14][33][40][41].
Asetik asit testinin önemli avantajları, basit ve ucuz olması, hemen sonuç vermesi nedeniyle hastanın tekrar çağrılmasına gerek duyulmaması ve tanıyla eş zamanlı olarak tedavi planlanabilmesidir. Başlıca dezavantajı ise spesifitesinin düşük olmasıdır[14][38].
Speküloskopi
Speküloskopi, asetik asit testinin varyantıdır. Asetik asitten sonra serviksin kemilüminesant ışık altında incelenerek spesifitenin yükseltilmesi amaçlanmıştır. Fakat yapılan çalışmalarda duyarlılık ve spesifitenin asetik asit testi ile benzer olduğu görülmüştür. Dolayısı ile asetik asit testine üstünlüğü yoktur, hatta daha pahalıdır[14][38].
HPV Testi
Servikal kanserde önemli etken olan HPV pozitifliği bakılması daha çok kombine testlerde kullanılmakta işe yarar.
Kombine Yöntemler
Testlerin herhangi bir kombinasyonu duyarlılığı artırsa da spesifiteyi düşürür ve ayrıca maliyeti de artırır.
30 yaş ve üstü kadınlarda HPV DNA testi ve servikal sitolojinin birleşimi, primer kanser taramasında diğer bir seçenektir. HPV-DNA testinin yüksek duyarlılığı ve servikal sitolojinin yüksek spesifitesinin birleşimi, kombine test sonucu normal olan kadınlarda tarama aralığını uzatacaktır. Kombine test sonucu normal olan bir kadında CIN-II ya da daha üst evreli bir lezyonun gözden kaçma olasılığı 1/1000’dir[14][42].
Belirti ve bulgular
Serviks kanseri erken evrelerinde asemptomatik olabilir[9]. Stromal invazyon ilerledikçe, hastalık klinik olarak belirgin hale gelir. Genital sistem muayenesinde görülebilen çeşitli büyüme paternleri gösterir. Erken lezyonlar; dokunmakla kanayan, kaba, kırmızımsı granüler alanlar şeklinde görülür.
Orta derecede ilerlemiş veya ilerlemiş invaziv serviks kanseri olan bu kadınlar sıklıkla aşağıdaki belirtilerden bir veya daha fazlasını gösterirler. Bu belirtiler: iştah azlığı, kilo kaybı, halsizlik, pelvik ağrı, sırt ağrısı, bacak ağrısı, tek taraflı şiş bacak, vajinadan aşırı kanama, vajinadan idrar veya gayta gelmesi[43] ve metastaz gelişmesine bağlı kemik kırıklarıdır. Ayrıca; intermenstrüel kanama, postkoital kanama, aşırı seropürülan akıntı, tekrarlayan sistit, bel ağrısı, alt abdominal ağrı, alt ekstremitede ödem, obstrüktif üropati, bağırsak obstrüksiyonu, ciddi anemiye bağlı nefes darlığı ve kaşeksi de görülebilen diğer bazı belirtilerdir. Özellikle vajinal kanama varlığında malignansi (habis tümör) varlığı akla gelmelidir. Bununla beraber, vajinal akıntıda artış ve cinsel ilişki sırasında ağrı da servikal kanser semptomlarıdır. Hastalığın ilerleyen safhalarında; abdomen, akciğer ve başka diğer bölgelere metastazlar görülebilir.
Daha ileri kanserler; kanama ve kötü kokulu akıntı ile birlikte, prolifere olan, kabartı oluşturan, mantar veya karnabahar benzeri büyüyen lezyonlar şeklindedir. Bazen fazla yüzeyel büyüme göstermeden, kaba, granüler yüzeyli, bütünü ile büyümüş irregüler serviks şeklinde görülür. İnvazyon arttıkça , vajina, parametrium (rahim çevresinde bulunan bağ dokusu), pelvik yan duvarlar, mesane ve rektum tutulur. İlerlemiş bölgesel hastalığa bağlı olarak üreter kompresyonu, hidronefroz ile sonuçlanan üreteral obstrüksiyona neden olur ve sonunda böbrek yetmezliği gelişir. Bölgesel invazyonun yanı sıra bölgesel lenf düğümlerine metastaz olur. Paraaortik lenf düğümlerindeki metastatik kanser lenf düğümünün kapsülünden dışarı yayılabilir ve doğrudan vertebrayı ve sinir köklerini tutarak sırt ağrısı oluşturabilir. Siyatik sinir köklerinin dallarının doğrudan yayılımı sırt, bel ve bacak ağrısına; pelvik duvar venlerinin ve lenfatiklerinin sıkıştırılması ise bacaklarda ödeme neden olur. Hastalıkta uzak metastazlar geç olur, genellikle paraaortik nodlar, akciğerler, karaciğer, kemik ve diğer yapılar tutulur[14][44].
Tanı yöntemleri
Kesin tanı -tüm kanserlerde olduğu gibi- biyopsi ile konulur. Yani altın standart biyopsidir. Tarama yöntemlerinde patoloji şüphesi durumda daha ileri tetkiklere ihtiyaç duyulur. LEEP (elektrocerrahi eksizyon yöntemi, Loop electrosurgical excision procedure; rahim ağzından lezyonlu bölgenin kesilip çıkarılması) ve konizasyon (koni şeklinde doku parçasının alınması) yöntemleri ile biyopsi materyali alınması ve bu materyalin histopatolojik incelenmesiyle tanı konulur.

Neoplastik değişiklikler skuamokolumnar bileşkeden (junction) başlar. Serviks kanseri gelişmesinde serviks epitelinde birbiri ardı sıra gelen değişiklikler olur, bu da serviks kanserinin erken tanısında önem taşır[14][15][44].
Bu değişiklikler sırasıyla:
- Normal endoservikal kolumnar epitel
- Skuamöz metaplazi
- Hafif-orta-ağır displazi
- Karsinoma in situ
- Mikroinvazif karsinom
- Belirgin invazif karsinom, şeklindedir[15].
Premalign lezyonların evrelendirilmesi
_CIN3.jpg)
Preinvaziv servikal hastalık kavramı, 1947 senesinde invaziv kanser görünümüne sahip ancak epitelle sınırlanan epitelial değişiklikler tanımlandığında ortaya atılmıştır. Displazi ve CIS'ın (Karsinoma in situ) sürekli bir olayın farklı basamaklarını teşkil ettiğini düşünen Richart, 1967 yılında servikal intraepitelial neoplazi (CIN I, II, III) terimini tanımlamıştır. Sonraki çalışmalar bu lezyonların tedavi edilmemeleri halinde servikal kansere yol açabileceğini gösterdi. Şimdi ise tedavi edilmediği zaman erken CIN lezyonlarının çoğunun eş zamanlı olarak gerilediği bilinmektedir[14][45]. Günümüzde anormal lezyonların gelişiminde premalign displastik değişikliklerin değerlendirilmesi için CIN sistemi kullanılmaktadır.
- Servikal intraephitelial neoplazi (CIN):
- CIN I Hafif displazi (atipik hücreler epitelin alt 1/3’ünde sınırlı)
- CIN II Orta displazi (atipik hücreler epitelin alttan 2/3'lük kısmında ise)
- CIN III Ağır displazi (epitelin tamamına yakını tutulmuş ise)
- CIS Karsinoma in situ (epitelin tamamı tutulmuşsa)
Not I: CIN I düşük evreli skuamöz intraepitelyal lezyon; CIN II/III yüksek evreli skuamöz intraepitelyal lezyon olarak da isimlendirilir[14][46][47].
Not II: Bütün lezyonlarda bazal membran sağlamdır[14][15].
İnvaziv servikal kanserler genellikle uzun bir preinvaziv hastalık evresini izlerler. Mikroskopik olarak, invaziv karsinomlara ilerlemeden önce hücresel atipiden, değişen derecelerde servikal intraepitelyal neoplazilere (CIN) ilerleyen prekürsor lezyonlar spektrumu ile karakterizedir. CIN I lezyonlarının büyük çoğunluğunun geçici olduğu; kısa dönemlerde normale gerilediği veya yüksek derecelere ilerlemediği iyi bilinmektedir. Diğer taraftan, yüksek dereceli (CIN II, III)'ler, her ne kadar bu tür lezyonların da bir kısmı gerilese de, yüksek oranda invaziv kansere ilerleme olasılığı taşır. Servikal öncü lezyonların invaziv kansere ilerlemesinin ortalama 10 ila 20 yıl kadar uzun bir zaman aldığı bilinmektedir[14][44].
Malign lezyonların evrelendirilmesi
Servikal kanserler için en yaygın kullanılan evreleme sistemi International Federation of Gynecology and Obstetrics (FIGO) tarafından geliştirilmiştir. Temelde tümör büyüklüğü ve hastalığın pelvisteki yayılımını esas alan bir klinik evreleme sistemidir. Kanserin büyüklüğü ve yaygınlığı klinik olarak birçok inceleme ile değerlendirilerek, hastalık evreleri I'den IV'e kadar kategorize edilmiştir. Evre I servikste sınırlı büyümeyi temsil ederken; evre IV, kanserin metastaz ile uzak organlara yayılımını belirtir[14][44].
- Evre 0: CIS (karsinoma insitu)
- Evre I: Tümör kesinlikle servikste sınırlıdır. Evre IA1 ve IA2 tanısı tercihen konizasyonla çıkarılan, tüm lezyonu kapsayan dokunun mikroskopik incelemesiyle konur.
- Evre IA: Tümör sadece mikroskopik olarak görülebilir.
- Evre IA1: Stromal yayılım 3 mm den küçük ve tümör 7 mm den geniş değildir.
- Evre IA2: Stromal yayılım 3–5 mm arasında ve tümör 7 mm den geniş değildir.
- Evre IB: Servikse sınırlı klinik lezyonlar veya Evre IA'dan büyük preklinik lezyonlar. Bütün belirgin lezyonlar yüzeyel yayılım olsa dahi Evre IB kanserlerdir.
- Evre IB1: 4 cm den büyük olmayan klinik lezyonlar.
- Evre IB2: 4 cm den büyük klinik lezyonlar.
- Evre IA: Tümör sadece mikroskopik olarak görülebilir.
- Evre II: Tümör serviksi aşmış, fakat pelvis duvarına ulaşmamıştır. Vajen tutulumu olabilir ancak alt 1/3'e ulaşmamıştır.
- Evre IIA: Belirgin parametrial tutulum yok. Vajenin üst 2/3'üne kadar tutulum vardır.
- Evre IIB: Belirgin parametrial tutulum vardır, ancak pelvis yan duvarına ulaşmamıştır.
- Evre III: Tümör pelvik duvara kadar ulaşmıştır. Rektal muayenede tümörle pelvis duvarı arasında serbest aralık yoktur. Tümör vajen alt 1/3'ünü tutmuştur. Hastalarda hidronefroz ve/veya böbrek yetmezliği bulguları vardır.
- Evre IIIA: Pelvis duvarına ulaşmamıştır, fakat vajen alt 1/3'ü tutulmuştur.
- Evre IIIB: Tümör pelvis duvarına ulaşmış veya hidronefroz veya nonfonksiyonel böbrek vardır.
- Evre IV: Tümör gerçek pelvisi aşmış veya klinik olarak mesane ve/veya rektum mukozası tutulumu vardır.
Tedavi
Kanseröz ve pre-kanseröz servikal oluşumlarda birçok tedavi seçeneği bulunmaktadır. Her vakada hasta ve hekim en uygun tedavi yöntemine karar verir. Ayrıca saptanan lezyonun evresi de tedavinin seçiminde önem kazanmaktadır:
- Erken evrelerde lazer, kriyocerrahi (oluşumu dondurma), LEEP (elektrocerrahi eksizyon yöntemi - Loop electrosurgical excision procedure) rahim ağzından lezyonlu bölgenin kesilip çıkarılması, konizasyon (koni şeklinde doku parçasının alınması) yöntemlerinden uygun görülenler uygulanabilir.
- İleri evrelerde histerektomi (kadın üreme organlarının alınması), radyoterapi (ışın tedavisi) ve kemoterapi (antikanser ilaçları ile tedavi) yöntemlerinden biri veya uygun olan kombinasyonları uygulanabilir[49][50][51][52].
Gidiş ve sonlanış
Prognoz kanserin evresine bağlıdır. Tedavi ile, 5-yıllık sağ kalım oranları, invaziv serviks kanserinin sadece erken evresi göz önüne alındığında %92, tüm evreler hesaba katıldığında ise 5-yıllık sağkalım oranı yaklaşık %72'dir. Bu istatistik sonuçları bu kanserin erken tanısının artmasından ötürü değişmiş olması muhtemeldir[53].
Teşhisten 5 yıl sonra tedavi ile sağkalım oranları, evre I kanser için %80-90, evre II için ise %50-65, evre III için sadece %25-35 ve evre IV için ise %15'ten azdır. Metastaz varlığında ise sağkalım oranları ciddi oranda düşmektedir.[54].
Korunma yöntemleri
Korunma yöntemleri birincil (primer), ikincil (sekonder) ve üçüncül (tertiar) korunma şeklinde üçe ayrılabilir.
Risk faktörleri=========>>Kanser öncülleri (prekürsör)=========>>İnvaziv kanser=========>>Ölüm
| | | | | | |
| | | | | | |
Cinsel davranış | HPV enfeksiyonu ve CIN | İnsidans oranı | Mortalite oranı
| | |
| | |
Primer korunma Sekonder korunma Üçüncül korunma
(aşılama) (tarama) (tedavi)
Erken tanı (tarama)
Tarama testleri ile erken tanı konulması tedavide başarı şansını arttırmaktadır. Ayrıntılı bilgi için tarama testleri adlı bölüme bakınız.
HPV aşısı
Etiyoloji'de HPV'nin anahtar rolü oynaması bu virüse karşı aşı çalışmalarını indüklemiş ve oldukça etkin koruyucu aşılar geliştirilmiştir. Yakın gelecekte bu aşıların kullanımının yaygınlaşmasıyla 20-30 yıllık bir süreçte serviks kanseri insidans ve mortalitesinde önemli azalmalar beklenmektedir[17].
Günümüzde 2006'da onaylanan quadrivalan (4'lü) ve 2007'de onaylanan bivalan (2'li) olmak üzere 2 çeşit HPV aşısı mevcuttur. Her iki aşının da adölesan dönemde uygulanması en yüksek immün yanıtı oluşturmaktadır[18]. Halen Amerikan İlaç Gıda Dairesi (FDA) ve Avrupa Komisyonu tip 6, tip 11, tip 16 ve tip 18 içeren HPV aşısı; servikal kanserlerin, yüksek dereceli servikal displazinin, prekanseröz servikal lezyonun, prekanseröz vulvar displastik lezyonların ve yaygın genital siğillerin (kondiloma akuminata) önlenmesi için onaylamıştır. Bu aşı 11-12 yaşlarında 3 doz olarak uygulanmaktadır. Bununla beraber 9-26 yaşlarında bu aşı uygulanabilir. Profilaktik HPV aşılarının rutin servikal tarama ile birlikte HPV ile ilişkili morbidite ve mortalite üzerinde çarpıcı etkileri olacağı öngörülmektedir[19].
Toplumda HPV'nin onkojenik türlerinin yaygınlığına bağlı olarak aşının HPV enfeksiyonlarını %65-76 oranında önlediği kanıtlanmıştır[7]. HPV 16 ve 18 suşlarına bağlı oluşan hastalıkları önlemede hem bivalan (2'li) hem quadravalan (4'lü) aşının koruyuculuğu %90'ın üzerindedir. Bununla beraber quadrivalan (4'lü) aşının %100 etkin olduğu çeşitli çalışmalarda gösterilmiştir[21].
Kaynaklar
- 1 2 3 4 5 6 Ceyhan M. İnsan papilloma virusu (HPV) aşısı uygulamasında ülkemizde mevcut problemler. ANKEM Derg 2007; 21(Ek 2):102-104. Tam metin
- 1 2 3 4 Akhan SE. Ülkemizde servikal kanser epidemiyolojisi ve HPV serotipleri. ankem derg 2007; 21(ek 2):96-98. Tam metin
- ↑ Walboomers JM, Jacobs MV, Manos MM, Bosch FX, Kummer JA, Shah KV, Snijders PJ, Peto J, Meijer CJ, Muñoz N. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol. 1999 Sep;189(1):12-9. PMID 10451482
- ↑ Lowy DR, Schiller JT. Prophylactic human papillomavirus vaccines. J Clin Invest. 2006 May;116(5):1167-73. PMID 16670757
- ↑ FDA Licenses New Vaccine for Prevention of Cervical Cancer. U.S. Food and Drug Administration 2006-06-08. Web sitesi Son giriş tarihi 2007-12-02
- ↑ Human Papillomavirus (HPV) Vaccines: Q & A - National Cancer Institute Web sitesi Son giriş tarihi 2008-07-18.
- 1 2 3 Bilir N. Serviks kanseri kontrolü çalışmaları ve HPV aşısı. Halk sağlığı uzmanları derneği teknik raporları no: 03 / 2007. Tam metin
- 1 2 "GLOBOCAN 2002 database: summary table by population". 23 Mayıs 2010 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20100523150458/http://www-dep.iarc.fr:80/GLOBOCAN/Table1_sel1.htm. Erişim tarihi: 2008-10-26.
- 1 2 Canavan TP, Doshi NR. Cervical cancer. Am Fam Physician. 2000 Mar 1;61(5):1369-76. PMID 10735343
- ↑ C Fidaner, S.Y Eser, D.M Parkin. "Incidence in Izmir in 1993-1994 : first results from Izmir Cancer Registry". Eur. Journal of Cancer 37: 83-92; yıl=2000. PMID 11165134.
- ↑ Haydaroğlu, A, Bölükbaşı, Y, Özsaran Z.. "Ege Üniversitesi'nde kanser kayıt analizleri: 34134 Olgunun değerlendirmesi". Türk Onkoloji Dergisi 22: 22-28 ; yıl=2007. http://onkder.org/text.php3?id=626.
- ↑ Castle PE, Wacholder S, Lorincz AT, Scott DR, Sherman ME, Glass AG, Rush BB, Schussler JE, Schiffman M. A prospective study of high-grade cervical neoplasia risk among human papillomavirus-infected women. J Natl Cancer Inst. 2002 Sep 18;94(18):1406-14. PMID 12237286
- 1 2 Hatch KD. Handbook of colposcopy. Diagnosis and treatment of Lower Genital Tract Neoplasia and HPV Infections. Boston:Litle, Brown and Co 1989;7-19.
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 Uyanıkoğlu, Hacer. Servikal kanser taramasında asetikasit sonrası inspeksiyonla (VIA), servikal smear'in karşılaştırılması. Uzmanlık tezi. İstanbul-2006. Tam metin
- 1 2 3 4 5 Barut A. Serviks Kanserinde Erken Tanı ve Tedavi. STED, mart 2000. Tam metin
- ↑ Overview: Cervical Cancer, What Causes Cancer of the Cervix?. American Cancer Society (2006-11-30). Retrieved on 2007-12-02. Tam metin
- 1 2 Güner H, Taşkıran Ç. Epidemiology of cervical cancer and the role of human papilloma virus. Türk Jinekoloji ve Obstetrik Derneği Dergisi 2007; 4(1):11-19. Tam metin
- 1 2 3 Cutts FT, Franceschi S, Goldie S, Castellsague X, de Sanjose S, Garnett G, Edmunds WJ, Claeys P, Goldenthal KL, Harper DM, Markowitz L. Human papillomavirus and HPV vaccines: a review. Bull World Health Organ. 2007 Sep;85(9):719-26. PMID 18026629
- 1 2 Salman N. İnsan papilloma virus aşısı. ANKEM Derg 2007;21(Ek 2):99-101. Tam metin
- ↑ Parkin DM. The global health burden of infection-associated cancers in the year 2002. Int J Cancer. 2006 Jun 15;118(12):3030-44. PMID 16404738
- 1 2 Ault KA. Epidemiology and natural history of human papillomavirus infections in the female genital tract. Infect Dis Obstet Gynecol. 2006;2006 Suppl:40470. PMID 16967912
- ↑ Hogewoning CJ, Bleeker MC, van den Brule AJ, Voorhorst FJ, Snijders PJ, Berkhof J, Westenend PJ, Meijer CJ. Condom use promotes regression of cervical intraepithelial neoplasia and clearance of human papillomavirus: a randomized clinical trial. Int J Cancer. 2003 Dec 10;107(5):811-6. PMID 14566832
- ↑ Panagiotis C, Efthimios D, Konstantinos P, George C. Human papilloma virus: diagnostic, treatment and preventive issues. Akush Ginekol (Sofiia). 2008;47(1):35-8. PMID 18642576
- ↑ Dağlı AF, Özercan MR. Servikal smear tarama programımızda sınırlılık/yetersizlik oranları ve nedenleri (1322 olgu). Fırat Tıp Dergisi 2006; 11(3):166-169. Tam metin
- 1 2 Akyüz A, Güvenç G, Yavan T, Çetintürk A, Kök G. Kadınların Pap smear yaptırma durumları ile bunu etkileyen faktörlerin belirlenmesi. Gülhane Tıp Dergisi 2006; 48:25-29. Tam metin
- ↑ Çiçek NM, Akyürek C, Çelik Ç, Haberal A. Kadın hastalıkları ve Doğum Bilgisi. 2. baskı. Ankara 2006; s: 863.
- 1 2 Davey DD, Austin RM, Birdsong G, Buck HW, Cox JT, Darragh TM, Elgert PA, Hanson V, Henry MR, Waldman J. ASCCP Patient Management Guidelines: Pap Test Specimen Adequacy and Quality Indicators. J Low Genit Tract Dis. 2002 Jul;6(3):195-199. PMID 17051020
- ↑ Kurman RJ, Henson DE, Herbst AL, Noller KL, Schiffman MH. Interim guidelines for management of abnormal cervical cytology. The 1992 National Cancer Institute Workshop. JAMA. 1994 Jun 15;271(23):1866-9. PMID 8196145
- 1 2 3 Solomon D, Davey D, Kurman R, et al. The 2001 Bethesda system: terminology for reporting results of cervical cytology. JAMA 2002; 287:2114.
- ↑ Fahey MT, Irwig L, Macaskill P. Meta-analysis of Pap test accuracy. Am J Epidemiol. 1995 Apr 1;141(7):680-9. PMID 7702044
- ↑ McCrory DC, Matchar DB, Bastian L, Datta S, Hasselblad V, Hickey J, Myers E, Nanda K. Evaluation of cervical cytology. Evid Rep Technol Assess (Summ). 1999 Jan;(5):1-6. PMID 11925972
- 1 2 Nanda K, McCrory DC, Myers ER, Bastian LA, Hasselblad V, Hickey JD, Matchar DB. Accuracy of the Papanicolaou test in screening for and follow-up of cervical cytologic abnormalities: a systematic review. Ann Intern Med. 2000 May 16;132(10):810-9. PMID 10819705
- 1 2 3 Cronjé HS, Cooreman BF, Beyer E, Bam RH, Middlecote BD, Divall PD. Screening for cervical neoplasia in a developing country utilizing cytology, cervicography and the acetic acid test. Int J Gynaecol Obstet. 2001 Feb;72(2):151-7. PMID 11166748
- ↑ Cronjé HS, Parham GP, Cooreman BF, de Beer A, Divall P, Bam RH. A comparison of four screening methods for cervical neoplasia in a developing country. Am J Obstet Gynecol. 2003 Feb;188(2):395-400. PMID 12592246
- ↑ Mitchell H, Hocking J, Saville M. Improvement in protection against adenocarcinoma of the cervix resulting from participation in cervical screening. Cancer. 2003 Dec 25;99(6):336-41. PMID 14681940
- ↑ Lee KR, Ashfaq R, Birdsong GG, Corkill ME, McIntosh KM, Inhorn SL. Comparison of conventional Papanicolaou smears and a fluid-based, thin-layer system for cervical cancer screening. Obstet Gynecol. 1997 Aug;90(2):278-84. PMID 9241308
- ↑ Wright TC Jr, Cox JT, Massad LS, Twiggs LB, Wilkinson EJ; ASCCP-Sponsored Consensus Conference. 2001 Consensus Guidelines for the management of women with cervical cytological abnormalities. JAMA. 2002 Apr 24;287(16):2120-9. PMID 11966387
- 1 2 3 Cronjé HS. Screening for cervical cancer in developing countries. Int J Gynaecol Obstet. 2004 Feb;84(2):101-8. PMID 14871510
- ↑ Ottaviano M, La Torre P. Examination of the cervix with the naked eye using acetic acid test. Am J Obstet Gynecol. 1982 May 15;143(2):139-42. PMID 7081324
- ↑ Stafl A. Cervicography: a new method for cervical cancer detection. Am J Obstet Gynecol. 1981 Apr 1;139(7):815-25. PMID 7211987
- ↑ Denny L, Kuhn L, Pollack A, Wright TC Jr. Direct visual inspection for cervical cancer screening: an analysis of factors influencing test performance. Cancer. 2002 Mar 15;94(6):1699-707. PMID 11920531
- ↑ Rosenthal AN, Panoskaltsis T, Smith T, Soutter WP. The frequency of significant pathology in women attending a general gynaecological service for postcoital bleeding. BJOG. 2001 Jan;108(1):103-6. PMID 11212982
- ↑ Rita NANDA (2006-06-09). Cervical cancer. MedlinePlus Medical Encyclopedia. National Institutes of Health. Retrieved on 2007-12-02.
- 1 2 3 4 5 Sankaranarayanan R, Ramani S, Wesley R. Servikal Neoplazilerde Gözle Tarama Pratik El Kitabı.1. baskı. Ankara 2005.
- ↑ Sheris JD, Wells ES, TSU VD, Bishop A: Cervical cancer in developing countries, A. Situation analysis. The world bank department of population. Health and Nutrition 1993.
- ↑ Agorastos T, Miliaras D, Lambropoulos A, Chrisafi S, Kotsis A, Manthos A, Bontis J (2005). Detection and typing of human papillomavirus DNA in uterine cervices with coexistent grade I and grade III intraepithelial neoplasia: biologic progression or independent lesions?. Eur J Obstet Gynecol Reprod Biol 121 (1): 99–103. doi:10.1016/j.ejogrb.2004.11.024. PMID 15949888
- ↑ Park J, Sun D, Genest D, Trivijitsilp P, Suh I, Crum C (1998). Coexistence of low and high grade squamous intraepithelial lesions of the cervix: morphologic progression or multiple papillomaviruses?. Gynecol Oncol 70 (3): 386–91. doi:10.1006/gyno.1998.5100. PMID 9790792
- ↑ International Federation of Gynecology and Obstetrics (FIGO) resmi sitesi
- ↑ Erstad, Shannon (2007-01-12). Cone biopsy (conization) for abnormal cervical cell changes, WebMD. Retrieved on 2007-12-02. Tam metin
- ↑ Jones WB, Mercer GO, Lewis JL, Rubin SC, Hoskins WJ (1993). Early invasive carcinoma of the cervix.. Gynecol. Oncol. 51 (1): 26–32. doi:10.1006/gyno.1993.1241. PMID 8244170. Retrieved on 2007-12-01.
- ↑ Dolson, Laura (2001). Trachelectomy. Retrieved on 2007-12-02.
- ↑ Burnett AF. Radical trachelectomy with laparoscopic lymphadenectomy: review of oncologic and obstetrical outcomes. Curr Opin Obstet Gynecol. 2006 Feb;18(1):8-13. PMID 16493253
- ↑ What Are the Key Statistics About Cervical Cancer?. American Cancer Society (2008-03-26). Retrieved on 2008-08-19. Tam metin
- ↑ Cervical Cancer. Cervical Cancer: Cancers of the Female Reproductive System: Merck Manual Home Edition. Merck Manual Home Edition. Retrieved on 2007-03-24. Tam metin
_CIN2.jpg)