Gen düzenleyici ağ
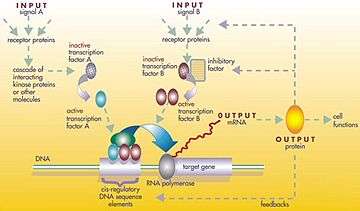
Gen düzenleyici bir ağın yapısı
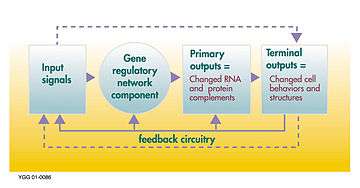
Gen düzenleyici bir ağın kontrol süreci
Gen düzenleyici ağ veya genetik düzenleyici ağ (GRN), bir hücre içinde (RNA ve protein ifadesinin ürünleri yoluyla) dolaylı olarak birbirleri ile etkileşim gösteren DNA bölümlerinin ve hücre içindeki diğer maddelerin bir koleksiyonu veya derlemesi olup ağlardaki hangi genlerin transkripsiyon sonucu mRNA'ya dönüştürüleceğini belirler. Genel olarak, her mRNA molekülü, belirli bir protein (veya protein dizilerinin) oluşturmak için yola çıkar. Bazı durumlarda bu protein, yapısal proteine dönüşür ve belirli yapısal özellikler oluşturmak için hücre zarında veya hücre içerisinde birikmeye başlar. Başka durumlarda protein bir enzim olacaktır ve bir besin kaynağını veya toksini parçalayarak yıkıma uğratmak gibi belirli bir tepki için kataliz görevini gören bir mikro-makineye dönüşecektir. Bazı proteinler ise sadece diğer genleri uyararak onları aktive etmek görevine sahip olup transkripsiyon faktörleri olarak düzenleyici ağlarda veya ardışık bağlantılardaki ana aktivatörlerdir. Diğer genlerin başlangıç uçlarındaki promotör bölgeye bağlanma ve böylece başka bir proteinin üretimini başlatma suretiyle onları etkinleştirirler ve bu, bu şekilde devam eder. Bazı transkripsiyon faktörleri önleyici olup inhibitör'dür.
Tek hücreli organizmalarda düzenleyici hücre ağları, bu ortamda hayatta kalmak için belirli bir zamanda hücreyi optimize ederek dış ortama yanıt verirler. Böylece bir şeker çözeltisi içinde kendini bulan bir maya hücresi, alkolu sakkaroza çeviren enzimleri oluşturan genlere dönüşecektir.[1] Alkollü içki ve şarapçılık ile ilişkilendirilen bu süreç, maya hücresinin çoğalmak için ihtiyacı olduğu enerjiyi kazanarak normal şartlar altında hayatta kalma olasılığını artırdığı ve kendi geçimini nasıl sağladığının bir yoludur.
Çok hücreli hayvanlarda aynı prensip vücut şeklini kontrol eden gen bağlanımlarına hizmet eder.[2] Bir hücre her defasında iki hücre oluşturacak şekilde bölündüğünde, tam olarak aynı genomu içermelerine karşın, hangi genleri etkinleştirecekleri ve hangi proteinleri oluşturacakları bakımından farklı olabilirler. Bazen "kendi kendini idame ettiren bir geri besleme döngüsü" bir hücrenin kendi kimliğini korumasını ve aktarmasını sağlama alır. Az anlaşılmış olan epigenetik bir mekanizm, kromatin modifikasyonun transkripsiyonu engelleyerek veya buna izin vererek hücresel bellek sunabilmesidir. Çok hücreli hayvanların önemli bir özelliği, bir hücreye vücudun neresinde bulunduğunu, dolayısıyla ne tür bir hücre olacağını söyleyen ve etkili bir konumlandırma sistemi sağlayan morfojen eğim ve gradyanları kullanmalarıdır. Hücre içinde etkinleştirilerek aktive edilen bir gen, içlerine girerek ve sadece belirli bir eşik seviyesinde bulunan başka genleri de aktive ederek hücreyi terk eden ve komşu hücreler içinde difüz yoluyla yayılan bir gen ürünü meydana getirebilir. Bu hücreler, böylece yeni bir kadere ikna edilmiş hücreler olarak yaratıcı hücreye geri sinyaller yollayan diğer morfogenler (morfoloji oluşturan genler) oluşturabilirler. Uzun mesafeler üstünden morfogenler, aktif sinyal iletimi sürecini (sinyal transdüksiyonu) kullanabilirler. Böyle bir sinyal iletimi, baştan sona kadar ardışık adımlar içinde embriyogenezi denetleyerek kontrol eder. Bu sinyal iletimi ayrıca geri bildirim süreçlerinden geçerek yetişkin organların korunmasını ve varlıklarını sürdürmelerini kontrol eder ve herhangi bir mutasyon nedeniyle böyle bir geri bildirimin kaybolması, kanser oluşumlarında da gözlemlendiği gibi kontrolsüz hücre çoğalmalarına neden olabilir. Bu yapı oluşturma sürecine paralel olarak gen bağlantı kaskatları, her hücrenin ihtiyacı olan fiziksel özellikleri sağlayan ve yapısal proteinleri oluşturan genlere dönüşürler. Biyolojik moleküler etkileşimler kendi özünde stokastik (olasılıksal) oldukları için, gen ağlarının hücresel süreçlerin nedeni değil sonucu oldukları ileri sürülmüştür (yani Hücresel Darwinizm).[3] Ancak deneylerde elde edilen son kanıt hücre kaderi yönündedir.[4]
Ayrıca bakınız
Dipnotlar
- ↑ "Transcriptional Regulatory Networks in Saccharomyces cerevisiae". Young Lab. 9 Şubat 2012 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20120209210206/http://web.wi.mit.edu/young/regulator_network/.
- ↑ Davidson E, Levin M (April 2005). "Gene regulatory networks". Proc. Natl. Acad. Sci. U.S.A. 102 (14): 4935. DOI:10.1073/pnas.0502024102. PMC 556010. PMID 15809445. http://www.pnas.org/cgi/content/full/102/14/4935.
- ↑ Constrained stochasticity and cellular Darwinism (stochastic gene expression in cell differentiation and embryo development), Dr Jean-Jacques Kupiec, Ecole normale superieure/INSERM, Last updated on 4 April 2011
- ↑ "Multistability and Multicellularity: Cell Fates as High-dimensional Attractors of Gene Regulatory Networks", Sui Huang, Vascular Biology Program, Children's Hospital / Harvard Medical School, Boston, MA 02115, Revised 3/2/05
Kaynakça
- Bolouri, Hamid; Bower, James M. (2001). Computational modeling of genetic and biochemical networks (Genetik ve Biokimyasal Ağların Bilgisayımsal Modellenmesi). Cambridge, Mass: MIT Press. ISBN 0-262-02481-0. (İngilizce)
- Kauffman SA (1969). "Metabolic stability and epigenesis in randomly constructed genetic nets (Rastlantısal Yapılandırılmış Genetik Ağlarda Epigenez)". J. Theoret. Biol. 22: 434–67. (İngilizce)
Dış bağlantılar
| Genetiğin alt dalları |
|---|
| | |
Diğer başlıklar: Genom · Sitogenetik · Moleküler evrim |
|

