Potasyum ferrosiyanür
| Potasyum ferrosiyanür | |
|---|---|
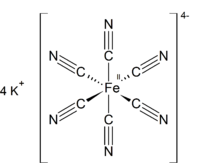 | |
6(H2O)3.tif.png) | |
 | |
| Potasyum hekzasiyanoferrat(II) | |
| Tanımlayıcılar | |
| CAS numarası | 13943-58-3 |
| PubChem | 161067 |
| Özellikler | |
| Molekül formülü | K4[Fe(CN)6] |
| Molar kütle | 368.35 gr/mol (susuz) 422.388 gr/mol (trihidrat) |
| Görünüm | Açık sarı, kristal granüller |
| Yoğunluk | 1.85 gr/cm3 (trihidrat) |
| Çözünürlük (su içinde) | trihidrat 28.9 gr/100 mL (20 °C) |
| Çözünürlük () | etanol, eterde çözünmez |
| Tehlikeler | |
| R-ibareleri | R32, R52, R53 |
| G-ibareleri | S50(B), S61 |
| NFPA 704 |
 0
1
0
|
| Parlama noktası | Tutuşmaz |
| LD50 | 6400 mg/kg (oral, sıçan)[3] |
| Belirtilmiş yerler dışında verilmiş olan veriler, standart haldedir. (25 °C, 100 kPa) | |
| Bilgikutusu kaynakları | |
Potasyum ferrosiyanür formülü K4[Fe(CN)6] • 3H2O olan bir kimyasal bileşiktir. Potasyum ferrosiyanür metal kompleks bileşiğinin [Fe(CN)6]4− potasyum tuzudur. Bu tuz limon sarısı monoklinik kristallerden oluşmuştur.
Üretimi
Modern üretimi
Potasyum ferrosiyanür endüstriyel olarak hidrojen siyanür, ferro klorür ve kalsiyum hidroksitten üretilmektedir. Bu maddelerin birleşimi Ca2[Fe(CN)6] • 11H2O bileşiğini verir. Daha sonra bu çözelti potasyum tuzlarıyla işleme sokularak kalsiyum-potasyum tuzu CaK2[Fe(CN)6] karışımı çökeltilir. Bu tuz da tetrapotasyum tuzunu vermesi için potasyum karbonatla işleme sokulur.[4]
Tarihsel üretimi
Çok eskiden, bileşik organik türevli azot içeren karbon kaynakları, demir talaşı ve potasyum karbonattan üretilmiştir.[5] Azot ve karbon kaynakları çoğunlukla, kurutulmuş boynuz, deri artıkları, sakatat ya da kurutulmuş kan olmuştur.
Kimyasal reaksiyonları
Potasyum ferrosiyanür nitrik asitle reaksiyona girerse H2[Fe(NO)(CN)5] bileşiğini verir. Bu ara ürünün sodyum karbonatla nötralize edilmesinden sonra, sodyum nitroprusiyatın kırmızı kristalleri kristalleştirilebilir.[6]
Klor gazı ile reaksiyona girerse, potasyum ferrosiyanür potasyum ferrisiyanüre dönüşür:
- 2 K4[Fe(CN)6] + Cl2 → 2 K3[Fe(CN)6] + 2 KCl
Bu reaksiyon, bir çözeltiden potasyum ferrosiyanürü uzaklaştırmak için kullanılabilir.
Çok bilinen bir reaksiyon ise ferrik tuzları ile karıştırıldığında Prusya mavisini vermesidir. Yaklaşık bileşimi KFe2(CN)6 olan çok koyu mavi renkteki suda çözünmez bu madde ozalitin mavi rengini oluşturur.
Kullanımı
Potasyum ferrosiyanür endüstride birçok uygulama alanlarında kullanılır. Potasyum ferrosiyanür ve sodyum ferrosiyanür hem yol tuzunda ve hem de sofra tuzunda topaklanmayı önleyici madde olarak yaygın bir şekilde kullanılmaktadır. Potasyum ve sodyum ferrosiyanürler kalayın saflaştırılmasında ve molibden cevherlerinden bakırın ayrılması için de kullanılır. Potasyum ferrosiyanür şarap ve sitrik asit üretiminde kullanılır.[4]
Laboratuvarda, potasyum ferrosiyanür redoks reaksiyonlarına dayalı titrasyon işlemlerinde sıkça kullanılan bir bileşik olarak potasyum permanganatın konstrasyonunu belirlemek için kullanılır. Potasyum ferrosiyanür X-galı parçalamak için kullanılan beta-galaktosidazı tamponlamak için potasyum ferrisiyanür ve tamponlanmış fosfat çözeltisi ile bir karışım halinde kullanılır. X- gal parçalandığında, yani beta-galaktosidaz enzimi hedefi olan Beta-gal molekülüne bağlandığında, bir antikor (veya diğer molekül)de parlak bir mavi görüntü verir. Fe(3) iyonları ile reaksiyona girerek Prusya mavisi rengini verir. Bu nedenle, laboratuvarlarda demir için bir tanımlama ayıracı olarak kullanılır.
Potasyum ferrosiyanür bitkilerde gübre olarak kullanılabilir.
Castner prosesinin bulunuşundan yani 1900 yılından önce, potasyum ferrosiyanür alkali metal siyanürlerin en önemli bir kaynağı idi.[4] Bu tarihsel süreçte, potasyum siyanür potasyum ferrosiyanürün parçalanmasıyla üretildi:[5]
K4[Fe(CN)6] → 4 KCN + FeC2 + N2
Yapısı
Diğer metal siyanürler gibi, katı potasyum ferrosiyanürün hem hidratlı ve hem de susuz tuzları karmaşık bir polimerik yapıya sahiptir. Polimerik yapının merkezindeki CN ligand (kimya)lara bağlı olan K+ iyonlarıyla çapraz bağlanmış oktahedral [Fe(CN)6]4- oluşur.[7] Katı potasyum ferrosiyanür suda çözündüğünde, K+---NC bağları kopar.
Zehirlilik
Potasyum ferrosiyanür zehirli değildir ve vücutta siyanüre parçalanmaz. Öldürücü dozunun (LD50) 6400 mg/kg olması nedeniyle sıçanlarda zehirliliği düşüktür .[2]
Ayrıca bakınız
- Ferrisiyanür
- Ferrosiyanür
- Potasyum ferrisiyanür
Yararlanılan kaynaklar
- ↑ https://play.google.com/books/reader?printsec=frontcover&output=reader&id=gXwPAAAAYAAJ&pg=GBS.PA8
- 1 2 "POTASSIUM FERROCYANIDE MSDS Number: P5763 - Effective Date: 12/08/96". J. T. Baker Inc.. 21 Kasım 2015 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20151121093949/http://hazard.com:80/msds/mf/baker/baker/files/p5763.htm. Erişim tarihi: 2012-04-08.
- ↑ http://chem.sis.nlm.nih.gov/chemidplus/rn/13943-58-3
- 1 2 3 Gail, E.; Gos, S.; Kulzer, R.; Lorösch, J.; Rubo, A.; Sauer, M.; Kellens, R.; Reddy, J.; Steier, N.; Hasenpusch, W. (October 2011). "Cyano Compounds, Inorganic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. DOI:10.1002/14356007.a08_159.pub3.
- 1 2 Von Wagner, Rudolf (1897). Manual of chemical technology. New York: D. Appleton & Co.. s. 474 & 477. http://babel.hathitrust.org/cgi/pt?id=uc2.ark:/13960/t3tt4gz1p;view=1up;seq=502.
- ↑ Seel, F. (1965). "Sodium Nitrosyl Cyanoferrate". Brauer, G.. Handbook of Preparative Inorganic Chemistry. 2 (2nd bas.). New York: Academic Press. s. 1768. LCCN 63-14307. http://www.scribd.com/doc/27443280/Handbook-of-Preparative-Inorganic-Chemistry-Vol-2-2d-Ed-George-Brauer.
- ↑ Willans, M.J.; Wasylishen, R.E.; McDonald, R. "Polymorphism of potassium ferrocyanide trihydrate as studied by solid-state multinuclear NMR spectroscopy and X-ray diffraction" Inorganic Chemistry 2009, volume 48, p4342-4353
Dış bağlantılar
- "Cyanide (inorganic) compounds fact sheet". National Pollutant Inventory Australia. 9 Nisan 2013 tarihinde kaynağından arşivlendi. http://web.archive.org/web/20130409165413/http://npi.gov.au/substances/cyanide/index.html.
| ||||||