Çevrim sonrası değişim
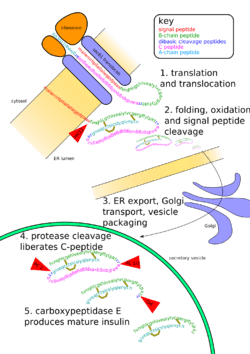
Çevrim sonrası değişim, (ingilizce Posttranslational modification) bir proteinin çevriminden (translasyonundan) sonra kimyasal değişime uğramasıdır. Çoğu protein için bu değişimler, protein biyosentezinin son adımlarındandır.
Proteinler (polipeptit olarak da adlandırılabilirler), amino asitlerden oluşan zincirlerdir. Protein sentezi sırasında proteine 20 farklı tür amino asit dahil edilebilir. Bunun ardından gelen çevrim sonrası değişimlerde (kısaca ÇSD), proteine yeni kimyasal fonksiyonel gruplar eklenerek (asetat, fosfat, çeşitli lipitler ve karbonhidratlar gibi) veya amino asidin şeklinin değişmesi ile (sitrülinleşme gibi), veya proteinde yapısal değişiklikler yapılmasıyla (disülfür bağ oluşturmak gibi) protein yeni işlevler kazanabilir.
Ayrıca, enzimler proteinin amino ucundan veya ortasından bir peptit kesip çıkarabilirler. Örneğin, bir protein hormon olan insülin, disülfür bağları oluşturduktan sonra iki yerden kesilir ve zincirin orta kısmından bir peptid alınır; meydana gelen protein birbiirine disülfür bağlarıyla iki polipeptitten oluşur.
Çoğu protein ilk sentezlendiğinde metiyonin ile başlar, çünkü mRNA'daki "başlama" kodonu aynı zamanda bu amino asidi de kodlar. Bu ilk metiyonin genelde çevrim sonrası değişimler sırasında kesilir.
Fosforilasyon gibi başka değişimler, proteinlerin davranışlarını kontrol etmek için, örneğin bir enzimi etkinleştirmek veya etkinsizleştirmek için, kullanılan mekanizmalardandır.
Fonksiyonel grup eklenen değişimler
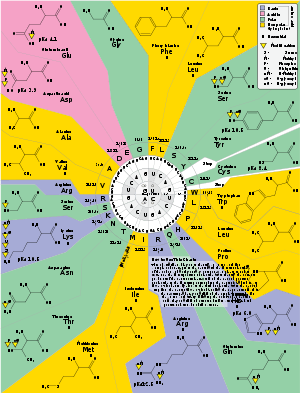
Eklenmeden oluşan ÇSD'ler arasında aşağıdakiler bulunmaktadır:
- asilasyon
- asetilasyon, proteinin ya N-ucuna[2] ya da lizin kalıntılarına [3] bir asetil grubu eklenmesi. (Ayrıca bakınız histon asetilasyonu)[4][5]
- deasetilasyon
- alkilasyon, bir alkil grubu (örneğin metil, etil) eklenmesi
- metilasyon bir metil grubu eklenmesi, genelde lizin veya arginin kalıntılarına. (Bu bir alkilasyon tipidir.)
- demetilasyon
- amidasyon, proteinin C-ucunda
- biyotinilasyon, lizin kalıntılarının bir biyotin grubu ile asilasyonu
- formilasyon
- gama-karboksilasyon, K vitaminine bağımlı olarak.[6]
- glutamilasyon, tübülin ve bazı başka proteinlere glutamik asit kalıntıları eklenmesi.[7] (Bkz. tubulin polyglutamylase)
- glikozilasyon, asparagin, hidroksilizin, serin veya treonin'e bir glikosil grubu eklenmesi ile bir glikoprotein oluşması. Bu süreç, enzim aracılığı olmaksızın şeker eklenmesi süreci olan glikasyondan farklıdır.
- glikasyon, enzim aracılığı olmaksızın şeker eklenmesi.
- glisilasyon, tübülin C-ucuna bir ilâ 40 adet glisin kalıntısı eklenmesi.
- hem parçası kovalent olarak bağlanabilir
- hidroksilasyon
- iyodinasyon (örn. tiroid hormonu)
- isoprenilasyon, bir isoprenoid grubu (örn. farnesol and geranylgeraniol) eklenmesi
- lipoylasyon, bir lipoat grubunun eklenmesi
- prenilasyon
- GPI çapa oluşumu
- miristoylasyon
- farnesilasyon
- geranilgeranilasyon
- nülleotitler veya türevleri kovalent bağlanabilir
- ADP-ribozilasyon
- flavin bağlantısı
- oksidasyon
- palmitoylasyon
- pegilasyon
- fosfatidilinositol kovalent bağlanabilir
- fosfopanteteinilasyon, koenzim A tarafından getirilen bir 4'-fosfopantetheinil parçasının eklenmesi (yağ asidi, poliketid, lösin ve ribozomsuz peptid sentezlerinde görülür.
- fosforilasyon, bir fosfat grubunun eklenmesi, genelde serin, tirozin, treonin veya histidin kalıntılarına
- polisialilasyon, NCAM'a polisialik asit eklenmesi
- piroglutamat oluşumu
- prolin rasemizasyon, prolil izomeraz tarafından
- tRNA-aracılıklı amino asit eklenmesi, arginilasyon gibi.
- sulfatlaşma, tirozine bir sulfat grubu eklenmesi.
- selenoylasyon (selenoproteinlere çevrim sırasında selenyum eklenmesi)
Başka protein veya peptitlerin eklendiği değişimler
- ISGilasyon, ISG15 (Interferon-Stimulated Gene 15) proteinin kovalent bağlanması[8]
- SUMOlaşma, SUMO protein'in (Small Ubiquitin-related MOdifier) kovalent bağlanması [9]
- ubikuitinleşme, ubikuitin proteininin kovalent bağlanması.
Amino asitlerin kimyasal yapısının değişimleri
- sitrulinleşme, veya deaminasyon, argininin sitrüline dönüşümü.
- deamidasyon, glutaminin glutamik aside, veya asparajinin aspartik aside dönüşümü
Yapısal değişimler
- disulfür köprüleri, iki sistein amino asidinin birbirine kovalent bağlanması
- proteolitik kesme, proteinin bir peptit bağından kesilmesi
Örnekler
- İnsülin üretimi sırasında onun kesilmesi ve disülfür bağlarının oluşumu
- Transkripsiyon düzenlenmesi için histonların ÇSM'si: kromatin yapısı tarafından RNA polimerazın kontrolü.
Kaynakça
- ↑ Gramatikoff K. in Abgent Catalog (2004-5) p.263
- ↑ Polevoda B, Sherman F (2003). "N-terminal acetyltransferases and sequence requirements for N-terminal acetylation of eukaryotic proteins". J Mol Biol 325 (4): 595–622. DOI:10.1016/S0022-2836(02)01269-X. PMID 12507466.
- ↑ Yang XJ, Seto E (2008). "Lysine acetylation: codified crosstalk with other posttranslational modifications". Mol Cell 31: 449–61. DOI:10.1016/j.molcel.2008.07.002. PMID 18722172.
- ↑ Bártová E, Krejcí J, Harnicarová A, Galiová G, Kozubek S (2008). "Histone modifications and nuclear architecture: a review". J Histochem Cytochem 56 (8): 711–21. DOI:10.1369/jhc.2008.951251. PMID 18474937.
- ↑ Glozak MA, Sengupta N, Zhang X, Seto E (2005). "Acetylation and deacetylation of non-histone proteins". Gene 363: 15–23. DOI:10.1016/j.gene.2005.09.010. PMID 16289629.
- ↑ Walker CS, Shetty RP, Clark K, et al (2001). "On a potential global role for vitamin K-dependent gamma-carboxylation in animal systems. Evidence for a gamma-glutamyl carboxylase in Drosophila". J. Biol. Chem. 276 (11): 7769–74. DOI:10.1074/jbc.M009576200. PMID 11110799.
- ↑ Eddé B, Rossier J, Le Caer JP, Desbruyères E, Gros F, Denoulet P (1990). "Posttranslational glutamylation of alpha-tubulin". Science 247 (4938): 83–5. DOI:10.1126/science.1967194. PMID 1967194.
- ↑ Malakhova, Oxana A.; Yan, Ming; Malakhov, Michael P.; Yuan, Youzhong; Ritchie, Kenneth J.; Kim, Keun Il; Peterson, Luke F.; Shuai, Ke; and Dong-Er Zhang (2003). "Protein ISGylation modulates the JAK-STAT signaling pathway". Genes & Development 17 (4): 455–60. DOI:10.1101/gad.1056303. PMID 12600939. http://www.genesdev.org/cgi/content/full/17/4/455.
- ↑ Van G. Wilson (Ed.) (2004). Sumoylation: Molecular Biology and Biochemistry. Horizon Bioscience. ISBN 0-9545232-8-8.