Şelasyon
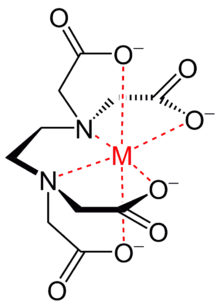
Şelasyon (çelasyon, veya kıskaçlama terimleri de kullanılır) iki veya çok dişli bir kimyasal ligandın iyonik bir substrata bağlanması veya komplekslenmesidir. Bu ligandlar, ki genelde organik bileşiklerdir, şelatör veya şelat ajanı olarak adlandırılır (diğer kullanılan terimler: şelant, çelatör, çelant, kıskaçlayıcı, iyon tutucu). Şelatörler, ASTM-A-380 standardına göre, "belli metal iyonları ile suda çözünür kompleksler oluşturan kimyasallardır, bu sayede iyonu etkinsizleştirerek onun başka elementler veya iyonlarla tepkitmeyerek, çökelek veya tortu oluşmamasını sağlar". Ligand, substrat ile birleşip bir şelat kompleksi meydana getirir (çelat terimi de kullanılır). Bu terim, metal iyonunu şelatördeki iki veya daha çok atomla bağlandığı kompleksler için kullanılır. Literatürde metal iyonu tutan bağların sayısına değinmek için dişlilik terimi kullanılır, örneğin yandaki resimde görülen EDTA altı dişli (İng. hexadendate) bir şelatördür.
Tarihçe
Şelasyon Yunanca kıskaç anlamına gelen χηλή, chelè ("kile" okunur) sözcüğünden gelir, Türkçeye Fransızca chélation 'dan, o dile de İngilizce chelation 'den girmiştir. Şelat (İng. chelate) terimi ilk defa 1920'de Sir Gilbert T. Morgan ve H. D. K. Drew tarafından kullanımıştır, "şelat sıfatı, istakoz veya benzeri kabukluların büyük kıskacının Yunanca adı chele 'den türetilmiştir; kumpas benzeri kimyasal grupların iki taraftan gelip ortadaki bir atomu bağlayarak heterosiklik halkalar meydana getirme özelliklerinden dolayı bu adı öneriyoruz" demişlerdir.[1]
Şelasyon etkisi
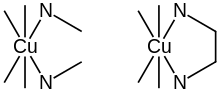
Sulu çözeltide bakır(II) iyonu, Cu2+ ve etilendiamin (aşağıda "en" kısaltmalı) arasındaki dengeyi ve gene Cu2+ ile metilamin (MeNH2) arasındaki dengeleri karşılaştıralım:
- Cu2+ + en
 [Cu(en)]2+ (1)
[Cu(en)]2+ (1) - Cu2+ + 2 MeNH2
 [Cu(MeNH2)2]2+ (2)
[Cu(MeNH2)2]2+ (2)
(1) denkleminde iki dişli ligand etilendiamin bakır iyonu ile bir şelat kompleksi oluşturur. Şelasyon sonucu beş atomlu bir halka oluşur. (2) denkleminde iki dişli kompleks yerine iki tane tek dişli metilamin ligandı vardır, yaklaşık aynı elektron verme kuvvetine sahiptir, yani Cu-N bağlarının oluşma entalpisi iki reaksiyon için yaklaşık eşittir. Aynı bakır konsantrasyonu için, metilamin konsantrasyonu etildiamin konsantrasyonunun iki katı olursa, kompleks (1)'in konsantrasyonu kompleks (2)'nin konsantrasyonundan daha fazla olacaktır. Şelat halkalarının sayısı arttıkça bu etki daha da artacaktır, öyle ki, altı halka meydana getiren EDTA kompleksinin konsantrasyonu (1) veya (2) kompleklserinkinden çok, çok daha fazla olacaktır. Böylece, şelat olgusu deneysel olarak kanıtlanabilir.
Şelat etkisini termodinamik açıklamasında tepkimenin denge sabitini göz önüne alınır: denge sabiti arttığı oranda kompleksin konsantrasyonu da artar.
- [Cu(en)] =β11[Cu][en]
- [Cu(MeNH2)2]= β12[Cu][MeNH2]2
Sadelik amacıyla yukarıda elektrik yükler gösterilmemiştir. Köşeli parantezler konsantrasyonu gösterir, kararlılık sabiti β'ların altyazıları kompleksin stokiometrisini gösterir. İki tepkimede de bakırın konsantrasyonu aynı, (2) tepkimesindeki metilamin'in analitik konsantrasyonu (1)'deki etilendiaminin konsantrasyonun iki katı olunca [Cu(en)] konsantrasyonu [Cu(MeNH2)2] konsantrasyonundan çok daha yüksektir çünkü β11 >> β12.
Denge sabiti K, standart Gibbs serbest enerjisi, ΔG![]() ile ilişkilidir:
ile ilişkilidir:
- ΔG
 = −RT ln K = ΔH
= −RT ln K = ΔH - TΔS
- TΔS
Burada R gaz sabiti, T ise Kelvin derecesi olarak sıcaklıktır. ΔH![]() reaksiyonun standart entalpi değişimi ΔS
reaksiyonun standart entalpi değişimi ΔS![]() ise standart entropi değişimidir. İki reaksiyon için de entalpi teriminin yaklaşık eşit olması gerektiği yukarıda belirtilmişti. Denklem (1)'de solda iki, sağda bir tanecik bulunmaktadır, denklem (2)'de ise solda üç, sağda bir tanecik vardır. Bu demektir ki, şelat kompleksi oluşunca daha az bir entropi kaybı olur. Entropi farkına katkıda bulunan faktörlerden biri budur. Diğer faktörler solvasyon değişimleri ve halka oluşmasıdır. Bazı deneysel veriler aşağıdaki tabloda bu etkiyi göstermektedir.[2]
ise standart entropi değişimidir. İki reaksiyon için de entalpi teriminin yaklaşık eşit olması gerektiği yukarıda belirtilmişti. Denklem (1)'de solda iki, sağda bir tanecik bulunmaktadır, denklem (2)'de ise solda üç, sağda bir tanecik vardır. Bu demektir ki, şelat kompleksi oluşunca daha az bir entropi kaybı olur. Entropi farkına katkıda bulunan faktörlerden biri budur. Diğer faktörler solvasyon değişimleri ve halka oluşmasıdır. Bazı deneysel veriler aşağıdaki tabloda bu etkiyi göstermektedir.[2]
Denge log β ΔG 
ΔH  /kJ mol−1
/kJ mol−1−TΔS  /kJ mol−1
/kJ mol−1Cd2+ + 4 MeNH2  Cd(MeNH2)42+
Cd(MeNH2)42+6.55 -37.4 -57.3 19.9 Cd2+ + 2 en  Cd(en)22+
Cd(en)22+10.62 -60.67 -56.48 -4.19
Bu veriler iki reaksiyon için standart entalpi değişimlerinin yaklaşık eşit olduğunu gösterir; şelat kompleksinin daha kararlı olmasının nedeni, standart entropi teriminin öbür reaksiyona kıyasla daha az olumsuz olmasıdır, hatta bu durumda açıkça reaksiyonun lehine işlemesidir. Genelde termodinamik değerlerin muhasebesini çözeltideki değişiklere göre yapmak zordur, ama şelat etkisinin başlıca entropi düzeyinde etkili olduğu barizdir.
Başka açıklamalar, Schwarzenbach'ın ki gibi[3], mevcuttur ve Greenwood & Earnshaw'da verilmiştir.
Doğada
Hemen her biyokimyasal reaksiyon bazı katyonları çözme yeteneği gösterir. Proteinler, polisakkaritler ve nükleik asitler çoğu metal iyonu için mükemmel çokdişli ligandlardır. Tesadüfi şelatörlere ek olarak bazı biyomoleküller özellikle belli metalleri bağlamak için üretilirler (bakınız sonraki bölüm). Histidin, malat ve fitoşelatin bitkilerce kullanılan tipik şelatörlerdir.[4][5][6]
Biyokimya ve mikrobiyolojide
Hemen tüm metaloenzimlerde şelatlanmış metaller bulunur, bunlar genelde peptitler, kofaktörlere ve prostetik gruplar tarfından tutulmuştur.[7] Bu tür şelatlayıcı ajanlar arasında hemoglobin ve klorofil de bulunan porfirin grubu da sayılabilir. Çoğu mikrop türünün ürettiği suda çüzünür pigmentler şelat ajanları olarak görev yapar, bunlar siderofor olarak adlandırılır. Örneğin, Pseudomonas türleri demir tutan pikosiyanin ve piyoverdin salgılarlar. E. coli tarafından üretilen Enterobaktin, bilinen en kuvvetli şelat ajanıdır.
Jeolojide
Yerbilimlerinde, hava şartlarından kaynaklanan aşınma (İng. weathering) organik şelatörlerin etkisine atfedilir, buna örnek olarak mineral ve taşlardan metal iyonlarını çıkartan peptit ve şekerler gösterilebilir.[8] Çevrede ve doğada bulunan çoğu metal kompleksi bir tip şelat halkasına içinde bağlıdır, örneğin bir hümik asit veya protein tarafından şelasyona uğramıştır. Dolayısıyla, metal şelatlar, topraktaki metallerin harekete geçmesi ve metallerin bitkilerde ve mikroorganizmalarda birikmesi olgularında rol oynarlar. Ağır metallerin seçici şelasyonu biyoremediasyonda (biyolojik yöntemlerle toprak veya sunu temizlenmesi) önemli bir konudur, örneğin radyoaktif atıklardan 137Cs'nin çıkartılması gibi.[9]
Uygulamalar
Şelatörler kimyasal analizde, su yumuşatmasında ve şampuan ve gıda koruyucularında kullanılırlar. Sitrik asit, sabun ve çamaşır deterjanlarında suyu yumuşatmak için kullanılır. Yaygın kullanılan sentetik bir şelatör EDTA'dır. Fosfonatlar da iyi bilinen şelasyon ajanlarıdır. Şelatörler su arıtım sistemleride ve özellikle su ısıtma kazanlarının bakım sistemlerinde kullanılır.
Ağır metal detoksifikasyonu
Şelasyon terapisi, cıva, arsenik ve kurşun zehirlenmesinde zehirli metal iyonlarının kimyasal olarak inert biçime gelip, vücutla daha fazla etkileşmeden atılmaları için şelat ajanlarının kullanılmasıdır; ABD Gıda ve İlaç İdaresi (FDA) tarafından 1991'den beri kullanımı onaylanmıştır.
Ağır metal zehirlenmesinde yararlı olsalar da, normal şartlarda şelat ajanları tehlikeli olabilir. ABD Hastalık Kontrol Merkezi (CDC), kalsiyum EDTA yerine disodyum EDTA kullanılmasının kalsiyum eksikliği (hipokalsemi) sonucu ölümlere yol açtığını bildirmiştir.[10]
Diğer tıbbî uygulamalar
Tetrasiklin ailesinden antibiyotikler Ca2+ ve Mg2+ iyonlarının şelatörleridir.
EDTA kanal tedavisinde kanalın lavajında kullanılır. Dentin'i yumuşatmaya yarayan EDTA, kanala boydan boya erişmeyi kolaylaştırır ve işlem sırasında meydana gelen kir tabakasını söker.
Gadolinyum(III) bileşikleri ve şelatları MRI görüntüleme tekniklerinde kontrast ajanı olarak kullanılır.
Çeşitli teknolojilerde kullanılan şelatörler
- Akrilik polimerler
- Askorbik asit
- Tetrasodyum iminodisüksinat
- Sitrik asit
- Dikarboksimetilglutamik asit
- Etilenediamindisüksinik asit
- Etilenediamintetraasetik asit (EDTA)
- Dietilen triamin penta (metilen fosfonik asit)'in hepta sodyum tuzu (DTPMP•Na7)
- Hidrolize yün
- Malik asit
- Nitrilotriasetik asit (NTA)
- Non-polar amino asitler (metiyonin gibi) ve polar aminoasitler (arjinin, asparajin, aspartik asit, glutamik asit, glutamin, lizin, ve ornitin gibi)
- Oksalik asit
- Fosforik asit
- Sideroforlar, Desferrioksamin B gibi
- Süksinik asit
Kaynakça
- ↑ Morgan, Gilbert T.; Drew, Harry D. K. (1920). "CLXII.—Researches on residual affinity and co-ordination. Part II. Acetylacetones of selenium and tellurium". J. Chem. Soc., Trans. 117: 1456. DOI:10.1039/CT9201701456.
- ↑ Greenwood, Norman N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd bas.). Oxford: Butterworth-Heinemann. s. 910. ISBN 0-7506-3365-4.
- ↑ Schwarzenbach, G (1952). "Der Chelateffekt". Helv. Chim. Acta 35: 2344–2359. DOI:10.1002/hlca.19520350721.
- ↑ U Krämer, J D Cotter-Howells, J M Charnock, A H J M Baker, J A C Smith (1996). "Free histidine as a metal chelator in plants that accumulate nickel". Nature 379: 635–638. DOI:10.1038/379635a0.
- ↑ Jurandir Vieira Magalhaes (2006). "Aluminum tolerance genes are conserved between monocots and dicots". Proc Natl Acad Sci USA 103 (26): 9749. DOI:10.1073/pnas.0603957103. PMID 16785425. http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1502523.
- ↑ Suk-Bong Ha, Aaron P. Smith, Ross Howden, Wendy M. Dietrich, Sarah Bugg, Matthew J. O'Connell, Peter B. Goldsbrough, and Christopher S. Cobbett (1999). "Phytochelatin synthase genes from arabidopsis and the yeast Schizosaccharomyces pombe". Plant Cell 11: 1153–1164. DOI:10.1105/tpc.11.6.1153. PMID 10368185. http://www.plantcell.org/cgi/content/full/11/6/1153?ck=nck.
- ↑ S. J. Lippard, J. M. Berg “Principles of Bioinorganic Chemistry” University Science Books: Mill Valley, CA; 1994. ISBN 0-935702-73-3.
- ↑ Dr. Michael Pidwirny, University of British Columbia Okanagan, http://www.physicalgeography.net/fundamentals/10r.html
- ↑ Prasad (ed). Metals in the Environment. University of Hyderabad. Dekker, New York, 2001
- ↑ U.S. Centers for Disease Control, "Deaths Associated with Hypocalcemia from Chelation Therapy" (March 3, 2006), http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5508a3.htm