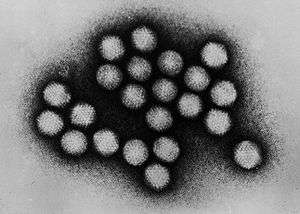
Virüs
|
| |||||||||||||||||||||||||||||||||||||
Virüs, sadece canlı hücreleri enfekte edebilen ve böylece replike olabilen mikroskobik enfeksiyon etkenleri. Virüsler: hayvanlardan ve bitkilerden, bakterilerin ve arkelerin de içinde bulunduğu mikroorganizmalara kadar her türlü canlı şekillerine bulaşabilirler.[1]
Dmitri Ivanovsky 1892 yılında bir makalede tütün bitkisine bulaşan bakteri olmayan etkenleri açıkladığından ve Martinus Beijerinck'in 1898 yılında tütün mozaik virüsünü keşfetmesinden beri,[2] 5,000 civarında virüs türü detaylı bir şekilde tarif edilse de[3] milyonlarca türde virüs vardır.[4] Virüsler yeryüzündeki hemen her ekosistemde bulunan biyolojk varlığın en bol türüdür.[5][6] Virüslerle ilgilenen bilime viroloji denir ve mikrobiyolojinin alt uzmanlık alanıdır.
Virüsler, enfekte hücre içerisinde veya enfeksiyon sürecinde, virionlar ve bağımsız viral parçacıklar halinde bulunabilir. Bir virüsün tüm yapılarını barındıran tek bir virüs partikülüne virion denir ve iki ya da üç parçadan oluşur: (i) DNA veya RNA'dan sadece birisi olabilen viral genom ve genetik materyali taşıyan büyük moleküller; (ii) genetik materyali saran, koruyan ve başka işlevleri de olan kapsid denilen bir protein tabakası, (iii) protein tabakayı saran lipit bir zarf. Virüs parçacıkları sarmal (helikal), kübik veya karmaşık (kompleks) morfolojilerde olabilmektedirler. Virionlar ışık mikroskobuyla görülemeyecek kadar küçük yapıdadırlar. Ortalama bir virion ortalama bir bakterinin yüzde biri büyüklüğündedir.
Yaşamın evrimsel tarihinde virüslerin menşei açıklanamamıştır: bazıları plazmidlerden evrimleşmiş olabilirler—hücreler arasında hareket edebilen DNA parçacıkları—bakterilerden evrimleşmiş olabilir. Evrimde, virüsler genetik çeşitliliği arttıran yatay gen transferinde önemli bir araçtırlar.[7] Virüsler genetik materyal taşıdıkları, üredikleri ve doğal seçilime uğradıkları için bazıları tarafından canlı kabul edilirler. Ancak canlı olarak kabul edebilmek için gerekli bazı anahtar özellikleri (ör. hücre yapısı) taşımadıkları için virüslere "yaşamın kıyısındaki organizmalar" ve kopyalanıcılar denilmiştir,[8] .[9]
Virüsler birçok yolla yayılırlar; bitkilerde virüsler genellikle yaprak bitleri ve bitki özsuyu ile beslenen böcekler tarafından bitkiden bitkiye aktarılırken, hayvanlarda kan emici haşerat tarafından aktarılırlar, bu hastalık taşıyan organizmalara vektörler denilir. Grip virüsleri solunum yoluyla yayılım gösterirler. Norovirüs ve rotavirüs viral kaynaklı gastroenteritin en bilindik etkenlerindendir ve fekal-oral bulaş yoluyla ve insandan insana temas ile, su ve yiyeceklerle bulaşırlar. HIV cinsel temas yoluyla ve enfekte kanla temas yoluyla bulaşan ciddi bir etkendir. Virüsün enfekte edebildiği hücrelere "konak" hücre denirve konak türü geniş veya dar olabilir, bunu virüsün "konak özgüllüğü" belirler.[10]
Hayvanlarda viral enfeksiyonlar genelde immun sistemin uyarılaması ve enfeksiyona neden olan virüsün ortadan kaldırılması ile sonuçlanır. Bağışıklık tepkileri aynı zamanda aşı ile de uyarılabilir, bu durum belirli viral ajanlara karşı yapay bir bağışıklık kazandırır. Bununla beraber AIDS ve viral hepatit etkeni olan bazı virüsler immun yanıttan kaçarlar ve kronik enfeksiyonlara yol açarlar. Antibiyotikler virüslere karşı etki etmezler ancak virüslere etki edebilen bazı antiviral ilaçlar geliştirilmiştir.
Etimoloji
Latinceden gelen vīrus kelimesi zehir anlamına gelmektedir ve Hint-Avrupa dil kökeninden gelen diğer zararlı sıvılar ile sanskritçede viṣa poison, Doğu İran dillerinde vīša poison, antik Yunancada ἰός poison aynı anlamdadır, bu kelimenin ilk tastiki 1398'de Bartholomeus Anglicus'un John Trevisa tarafından İngilizce tercümesi olan De Proprietatibus Rerum'da yapılmıştır. 1400'lerde Latincede Virulent, virulentus (zehirli) kelimesi kullanılmıştır.[11][12] Dmitri Ivanovsky'nin 1892'de virüsları keşfinden önce "bulaşıcı hastalığa neden ajan" anlamı ilk kez 1728'de kayda girmiştir.[13][14][15][16] Viral sıfatı 1948'de kullanılmıştır. Virion terimi (çoğulu virionlar) 1959'da, Özgül hücreleri enfekte edebilen tek bir stabil enfektif viral partikül anlamında kullanılmıştır.[17]
Târihçe
Louis Pasteur kuduz için bir nedensel ajan bulamadı ve bir mikroskop kullanılarak tespit edilemeyecek kadar küçük bir patojenle ilgili spekülasyonlar yaşandı.[18] 1884'te, Fransız mikrobiyolog Charles Chamberland, bakteriden daha küçük gözeneklere sahip olan filtreyi icat etti (günümüzde Chamberland filtresi ya da Chamberland-Pasteur filtresi olarak bilinir). Böylece, bakteri içeren bir çözeltiden bakteriler tamamiyle ayrıştırılabildi. 1892'de, the Rus biyolog Dmitri Ivanovsky şimdiki tütün mozaik virüsü olarak bilinen virüsü incelemek için bu filtreyi kullandı. Deneylerinde enfekte tütün bitkilerinin ezilmiş yapraklarından elde edilen çözeltilerin süzülmesi sonucunda süzülen sıvıda etkenlerin süzülmeden kaldığını gözlemledi. Ivanovsky enfeksiyonun bakteriler tarafından üretilen bir toksin tarafından meydana geldiğini öne sürdü, ancak bu düşüncesini sürdürmedi. O zamanlar tüm enfeksiyöz ajanların filtreler tarafından süzülebildiği ve üretilme ortamlarında üreyebildikleri düşünülmekteydi – Bu düşünce hastalık yapıcı mikrop teorisinin bir parçasıydı.[2] 1898'de, Hollandalı mikrobiyolog Martinus Beijerinck bu deneyleri tekrarladı ve süzülmüş çözeltinin enfeksiyöz ajanların yeni bir formunun içerdiğine ikna oldu. Bu ajanların sadece bölünebilen hücrelerde çoğaldıklarını gözlemledi ancak bu deney sonucunda hastalık oluşturan partikülleri göremedi, ajanlara contagium vivum fluidum (çözünür canlı mikroplar) adını verdi ve sonra virüs olarak yeniden adlandırıldı. Beijerinck virüslerin doğada sıvı olarak bulunduğunu savunmuştur, daha sonra bu teori virüslerin partikül olduğunu düşünen Wendell Stanley tarafından düşürülmüştür. Aynı yıl içinde Friedrich Loeffler ve Paul Frosch ilk hayvan virüsü olan şap hastalığı virüsünü tescillediler.
20. yüzyılın başlarında, İngiliz bakteriyolog Frederick Twort, şimdilerde bakteriyofaj (ya da sadece faj) denilen ve bakterileri enfekte eden virüs gruplarını keşfetti.[19] Fransız-Kanadalı mikrobiyolog Félix d'Herelle, besiyerindeki bakterilere süspansiyon şeklinde eklendiğinde onları öldüren virüsları tanımladı. Bu süspansiyonları seyrelterek en yüksek seyreltmeyi keşfetti (en düşük virüs konsantrasyonları), tüm bakterilerin ölmesinden ziyade, ölü organizmaların oluşturduğu alanları gözlemledi. Bu alanları sayma ve seyreltme faktörü ile çarparak orijinal süspansiyondaki virüslerin sayısını hesaplamaya çalıştı.[20] Fajlar tifo ve kolera gibi hastalıkların olası tedavisi gibi takdim edildi, ancak penisilinin geliştirilmesi ile bir kenara bırakıldılar. Faz çalışmaları, genlerin açılıp kapanma mekanizmalarını ve yabancı genlerin bakteri hücrelerine aktarılmaları için kullanışlı bir mekanizmayı anlamayı destekledi .
19. yüzyılın sonlarında virüsler, enfeksiyonları, filtrelerden geçebilmeleri ve yaşamaları için konağa gereksinim duymaları bakımından tanımlanmışlardır. Virüsler sadece bitki ve hayvanlarda üretilebilmişlerdi. 1906'da, Ross Granville Harrison lenf dokusu yetiştirmek için bir yöntem icat etti ve 1913'te E. Steinhardt, C. Israeli, ve R. A. Lambert, gine domuzu kornea dokusu parçalarında Vaccinia virüsü üretme amacıyla bu metodu kullandı.[21] 1928'de, H. B. Maitland ve M. C. Maitland, kıyılmış tavuk böbreği süspansiyonunda vaccinia virüsü ürettiler. Bu metotlar 1950'lerde aşı üretimi için büyük ölçekte poliovirüs üretilene kadar geniş ölçüde kabul edilmediler, .[22]
Diğer bir atılım 1931'de geldi, Amerikan patologlar Ernest William Goodpasture ve Alice Miles Woodruff influenzavirüs ve bazı diğer virüsleri döllenmiş tavuk yumurtasında ürettiler.[23] 1949'da, John Franklin Enders, Thomas Weller ve Frederick Robbins insan embriyo hücre kültüründe poliovirüs ürettiler ve böylece sağlam hayvan dokuları ve embriyonlu yumurta dışında virüs ürtilmiş oldu. Bu çalışma etkili polio aşısı üretmek için Jonas Salk tarafından yapıldı.[24]
Virüslerin ilk görüntüleri, Alman mühendisler Ernst Ruska ve Max Knoll tarafından 1931'de elektron mikroskobunun icadı üzerine elde edildi.[25] 1935'te, Amerikan biyokimyacı ve virolog Wendell Meredith Stanley tütün mozaik virüsü ile ilgili çalışmalar yaptı ve çoğunlukla protein yapılardan oluştuğunu buldu.[26] Kısa bir süre sonra, virüsler proteinler ve RNA parçalarına ayrıştırıldılar. Tütün mozaik virüsü ilk kez kristalize edildi ve yapısı bu nedenle ayrıntılı olarak tarif edilebildi. Kristalize virüsün ilk x ışını kristalografi görüntüleri Bernal ve Fankuchen tarafından 1941'de elde edildi. Bu görüntüleri temel alan Rosalind Franklin 1955 yılında virüsün tam yapısını keşfetti. Aynı yıl içinde, Heinz Fraenkel-Conrat ve Robley Williams saflaştırılmış tütün mozaik virüsünün RNA ve protein kapsidinin kendi kendine birleşip fonksiyonel virüs formunu oluşturabildiğini gösterdi, bu basit mekanizmanın muhtemelen virüslar tarafından konak hücre içinde oluşturulduğu düşünüldü.
20. yüzyılın ikinci yarsında virüs keşfi altın çağını yaşadı ve bu yıllarda 2000'den fazla hayvan, bitki ve bakteri virüsu türü keşfedildi. 1957'de, atların viral arteritine yol açan equine arterivirüs ve sığır viral diyare virüsü (bir pestivirüstür) keşfedildi. 1963'te, hepatit B virüsü Baruch Blumberg tarafından keşfedildi, ve 1965'te, Howard Temin ilk retrovirüsü tanımladı. Ters transkriptaz enzimi retrovirüsler tarafından kendi RNA'larından DNA kopyalamada kullanılır ve ilk kez birbirinden bağımsız olarak Howard Martin Temin ve David Baltimore tarafından 1970'te tanımlanmıştır. 1983'te Luc Montagnier'in takımı Fransada Pasteur Enstitüsünde, şimdilerde HIV olarak bilinen retrovirüsü ilk kez izole ettiler.
Canlılık tartışması
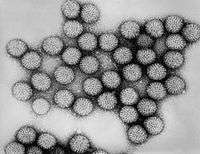
Virüsler ve canlı hücreler, DNA veya RNA, ve proteinler gibi ortak bileşiklere sahiptirler. Lakin biyokimyacı Wendel Stanley'nin tanımına göre virüsler biyolojik moleküllerden "basit" oluşumlardır. Organik moleküllerin kendi kendilerine yapısallaşma özeliklerinin bir sonucudurlar ve dolayısıyla canlı sayılmazlar. François Jacob da virüsler hakkında "bir kültür ortamına yerleştirildiklerinde virüslerin bir metabolik faaliyeti yoktur, enerjiyi ne üretebilirler ne de kullanabilirler, ne büyür ne çoğalabilirler, canlıların bu ortak özelliklerinden hiçbiri yoktur onlarda" der.[27] Virüsler ancak canlı bir hücrenin enzimlerini kullanarak çoğalabilirler. Ayrıca, virüsler DNA veya RNA'dan birine sahip olsalar da, canlı hücrelerde olduğu gibi bunların ikisi birden yoktur.
Öte yandan son yıllarda yapılan yeni keşifler virüslerin canlılığı hakkındaki tartışmayı yeniden gündeme getirmiştir. Amipleri enfekte eden Mimivirüsün 1200 geni vardır, ki bu rakam bâzı bakterilerin gen sayısından daha fazladır. Bu virüslerin genleri arasında normalde virüslerde bulunmayan, canlı hücrelerde bulunan 30 kadar gen vardır, örneğin protein sentezi ve DNA tamirinden sorumlu enzimleri kodlayan genler.[28]
Virüslerin canlı olup olmadığı tartışması sürmektedir. Sorunun cevaplandırılması için "hayat nedir?" sorusunun cevabı gerekmektedir. Zooloji ve botaniğe dayalı kıstaslara göre virüsler canlı değildir. Ancak, bu çıkarım canlı olduğu kabul görmüş varlıkların özelliklerinden genelleme yaparak elde edilmiştir ve yıllar boyunca keşfedilmiş, gittikçe daha küçük canlı türlerini göz önüne alarak sürekli değiştirilmiş tanımlara dayalıdır. Eğer hayat temel ilkelere göre tanımlanırsa, canlılığın en temel kıstası çoğalma yeteneğidir. Virüsler çoğalabildiklerine göre canlı oldukları, veya konak hücreler olmadan çoğalamadıkları için canlı olmadığı iddia edilebilir. Öte yandan pek çok canlı da diğer canlıların ürettiği gıdalar olmadan ne büyüyebilir ne çoğalabilir. Virüslerin canlı olup olmadığı kullanılan hayat tanımına bağlıdır.
Hayatı yahut canlılığı tanımlarken Alman bilim adamı Hoimar von Ditfurth şu yorumu yapmıştır:
"Amerikalı biyokimyacı ve Nobel Ödülü sahibi Melvin Calvin'in bilimsel bir yazısından aktarılmış 'canlılık:düzenli enerji dönüştürme mekanizmasına ilişkin bilgiyi başka bir özdeş sisteme aktarabilme yeteneği' tanımı, içinden çıkılmazlığıyla aslında sorunun güçlülüğünü ortaya koyuyor. Canlı olmayan ile canlı olanı birbirinden ayırt etmeye kalkışmak, aslında doğaya kendisinde bulunmayan bir duruma ilişkin dıştan bir 'müdahale' ve bu müdahaleye bağlı bir kavram getirme anlamına gelmektedir. Gerçekten de böyle bir girişim doğaya kendisinin tanımadığı sınırları yerleştirmekle eş anlamlıdır. Aslında bu türden sınırların gerçekte karşılığı bulunmayan yapay sınırlar oldukları kesindir. Doğanın o sayısız olayları ve süreçleri karşısında derli toplu bir bakış edinebilmek ve kolaylık sağlayıcı sınıflandırmalar yapabilmek için doğaya dıştan aklın bulunduğu ayırıcı çizgiler yerleştirmek, Dünya'yı gerçekte bulunmayan enlem ve boylam çizgilerine bölmekten hiç farklı değildir. Yön bulmamıza yardımcı olan ve coğrafî alanlar ya da noktalarda nereleri kastettiğimizi kolaylıkla belirtmemizi sağlayan haritalar üzerindeki bu kavramsal çizgileri hiç kimsenin kalkıp da söz konusu bölgelerin doğal bir özelliğini algılayabileceği gibi, bu çizgileri de o bölgelerde aramak kimsenin aklına gelmeyecektir."
Kökenleri
Virüsler hayatın olduğu her yerde bulunurlar ve canlı hücrelerin ilk geliştiği andan beri muhtemelen virüsler da vardı. Virüslerin kökenleri bilinmemektedir çünkü fosil formları bulunmamaktadır, virüslerin kökenlerini bulabilmek için DNA ve RNA karşılaştırmasını kullanan moleküler teknikler uygulanmıştır. Ek olarak, viral genetik materyal bazen konak hücredeki gen bölgelerine entegre olabilir, bu yolla virüs genomu nesille boyu dikey olarak aktarılabilir. Bu bilgiler milyon yıllar önceki antik virüslerin izini sürmeye çalışan paleovirologlar için pahabiçilemezdir. Şu anda, Virüslerin kökenini açıklamaya çalışan üç ana hipotez vardır:[29]
- Gerileme hipotezi
- Virüsler bir zamanlar, şimdiki boyutlarından büyük parazitik küçük hücreler olabilirler. Zamanla, parazitlik için gerekli olmayan genlerini kaybetmiş olabilirler. Rickettsia ve chlamydia bakterileri tıpkı virüsler gibi canlı hücrelerde yaşayabilirler ve sadece konak hücrelerde çoğalabilirler. Parazit yaşamı benimsemiş canlıların yaşamlarını ve bağımlılıklarını kodlayan genler dışındaki gereksinim duymadıkları genleri hücre dışında atıp kaybetmiş olabilme ihtmali bu hipotezi desteklemektedir. Bu aynı zamanda dejenerasyon hipotezi ya da azalma hipotezi olarakta adlandırılır.
- Hücresel kökenli hipotezi
- Bazı virüsler kendilerinden daha yüksek organizma hücrelerinden kaçan DNA ya da RNA parçalarından evrimleşmiş olabilirler. Kaçan DNA'lar plasmidlerden (hücreler arasında hareket edebilen çıplak DNA parçaları) ya da transpozonlardan (hücre içindeki gen bölgelerinde farklı konumlara hareket edebilen ve kopyalanabilen DNA molekülleri) gelmiş olabilirler.[30] Bir zamanlar "atlayan genler" denen transpozonlar hareketli genetik materyallerin örnekleridir ve bazı virüslerin kökeni olabilir. Barbara McClintock tarafından 1950 yılında mısır bitkisinde keşfedildiler.[31] Bu hipotez bazen serserilik hipotezi,[32] ya da kaçış hipotezi olarak da adlandırılır.
- Birlikte evrim hipotezi
- Ayrıca ilk-virüs hipotezi de denmektedir ve virüslerin ilk hücrelerin ortaya çıkmasından bu yana hücresel yaşama bağımlı olarak milyonlarca yıl boyunca karmaşık protein ve nükleik asit komplekslerinden evrimleştiğini önermektedir. RNA'dan oluşan Viroidlerler virüs olarak sınıflandırılmamışlardır çünkü viroidleri saran protein bir kılıf yoktur ancak, birkaç virüse benzeyen karakteristik özelliklerinden dolayı sık sık subviral ajanlar olarak adlandırılırlar.[33] Viroidler bitkiler için önemli hastalık etkenleridir. Protein kodlamamalarına karşın konak hücre ve konak hücre mekanizmalarıyla etkileşime girerek replike olurlar. RNA genomuna sahip insan hepatit delta virüsü viroidlere benzer fakat hepatit B virüslerinde bir protein kılıf elde eder ama kendisi bu kılıfı replike ettiremezler, bu nedenle bu etkene defektif virüs denmektedir. Bunun yanında hepatit delta virüsü konak hücreye girebilirse, bağımsız olarak replike olabilir. Replike olan hepatit delta virüsleri da defektiftir ve yeni hücreleri enfekte edebilmeleri için hepatit B virüsünün protein kılıfına gereksinim duyar. Aynı davranış, uydu virofajında da mevcuttur, bunlar Acanthamoeba castellanii türü protozoonları enfekte eden mimivirüslere bağımlıdırlar. Bu virofaj, diğer virüs türlerinin konak hücrede aynı anda bulunmasına gereksinim duyar, bunlara uydu denilir ve viroidlerin ve virüslerin evrimsel ara ürünleri temsil edebileceği düşünülmektedir.[34]
Geçmişte, bu hipotezlerin hepsi ile ilgili sorunlar vardı: en küçük hücresel parazitlerin bile virüslere benzememesi nedeniyle gerileme hipotezi açıklanmakta zorlanılmıştır. Kaçış hipotezinde, karmaşık kapsidlerin, virüslerin diğer parçacıklarının ve yapılarının nasıl oluştuğunun açıklaması yapılamamıştır. Birlikte evrim hipotezinde de virüslerin konak hücre gereksinimlerini açıklayamamıştır. Şimdilerde virüslerin antik ve üç üst alemin tarih öncesi bir ayrışımına ait oldukları kabul edilmektedir. Bu keşif modern virologları tekrardan düşünmeye ve klasik üç üst alem hipotezini yeniden değerlendirmeye sevketmiştir.
RNA dünyası hipotezi, virüslerin bilgisayar analizi ve konak DNA dizileri, farklı virüsler arasındaki evrimsel ilişkileri daha iyi anlamamızı sağlar ve modern virüslerin atalarını belirlemenize yardımcı olabilir. Günümüzde, analizler herhangi bir hipotezi doğrulamamaktadır. Ancak, tüm bilinen virüsler ortak bir atası var zor görünüyor, ve muhtemelen virüsler geçmişte farklı farklı mekanizmalar ile birçok kez ortaya çıkmışlardır.
Prionlar DNA ya da RNA barındırmayan infeksiyöz protein molekülleridir. Koyunlardaki scrapie gibi enfeksiyöz hastalıklara neden olurlar, sığırlarda bovin spongiform ensefalopati ("deli dana hastalığı"), ve geyiklerde kronik halsizlik hastalığı; insanlarda, prionik hastalıklar "gülme hastalığı" olarak ta bilinen Kuru hastalığı, Creutzfeldt–Jakob hastalığı, ve Gerstmann–Sträussler–Scheinker sendromu. Prionlar temelde viroidlerden ve virüslerden farklı olamasına rağmen keşfedilemeleri, virüslerin kendini kopyalayan moleküllere evrimleşmiş olduğu teorisini destekler.
Sınıflandırma
Sınıflandırma ve adlandırma, virüslerin benzer ya da farklı özellikleri dikkate alınarak yapılmaktadır. 1962'de, André Lwoff, Robert Horne, ve Paul Tournier linnean hiyerarşik sistemi baz alan ilk virüs sınıflandırma şeklini geliştirmişlerdir. Bu sistem şube, sınıf, takım, aile, cins, ve tür sınıflantırmasını temel alır. Virüslerin genom türlerini baz alan gruplandırmalar da yapılmıştır. Sonraları Uluslararası Virüs Taksonomisi Komitesi (UAVTK) kuruldu. Ancak virüsler şube ve sınıf olarak sınıflandırılmadı, bunun nedeni küçük genomları ve yüksek oranda mutasyona uğramaları nedeniyle yaşanan zorluklar sebebiyle takımın ötesinde tanımlamaya geçilmemesidir. Geleneksel hiyerarşiyi desteklemek için Baltimore Sınıflandırması kullanıldı.
UAVTK sınıflandırması
- Konu hakkında ayrıntılı bilgi için Uluslararası Virüs Taksonomisi Komitesi maddesine bakınız.
Şu andaki sınıflandırmayı Uluslararası Virüs Taksonomisi Komitesi geliştirdi ve aile bütünlüğünü korumak için virüs ailelerinin özelliklerine ağırlık veren bir rehber yayınladı. virüsleri sınıflandırmak için uluslararası birleşik bir taksonomi kuruldu. 9. UAVTK raporunda viral taksonların dallanma hiyerarşisinde en düşük takson gurubu olarak virüs türü kavramı tanımlanmıştır.[35] Ancak günümüzde virüsleri ve virüs çeşitliliğinin sadece çok küçük bir bölümü incelenmiştir.[36]
Genel taksonomik yapı aşağıdaki gibidir:
Mevcut (2013) UAVTK taksonomisi, 7 takımdan oluşur, Caudovirales, Herpesvirales, Ligamenvirales, Mononegavirales, Nidovirales, Picornavirales, and Tymovirales. Komite alt tür, suş ve izolatlar arasında resmi bir ayrım yapmamaktadır. Toplamda 7 takım, 103 aile, 22 alt aile, 455 cins, 2,827 civarında tür vardır ve 4,000'den fazla tip henüz sınıflandırılmamıştır.[37]
Baltimore sınıflandırması
- Konu hakkında ayrıntılı bilgi için Baltimor sınıflandırması maddesine bakınız.
Nobel ödüllü biylog David Baltimore, Baltimore sınıflandırma sistemini geliştirmiştir. UAVTK sınıflandırma sistemini, modern sınıflandırma sistemleri ve Baltimore sınıflandırma sistemini bağdaştırarak yapmıştır.
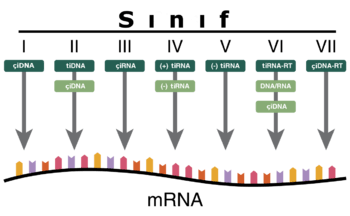
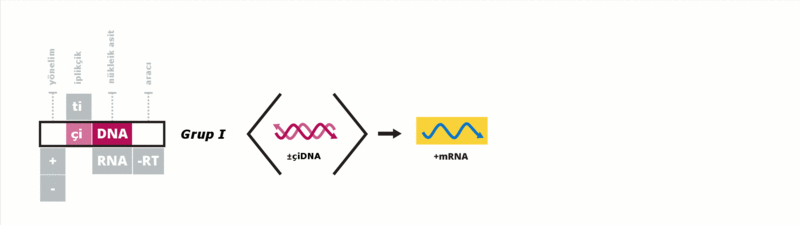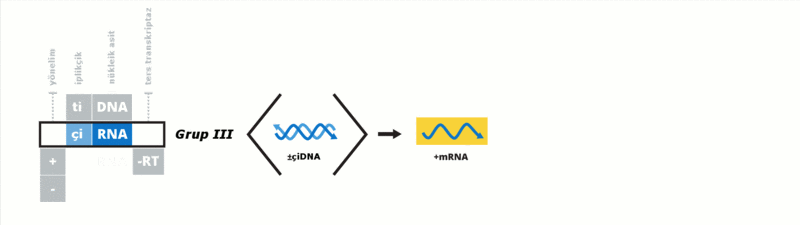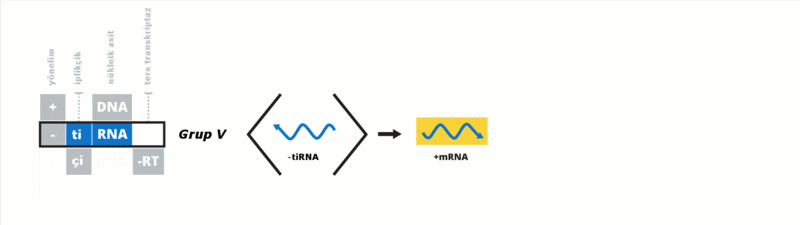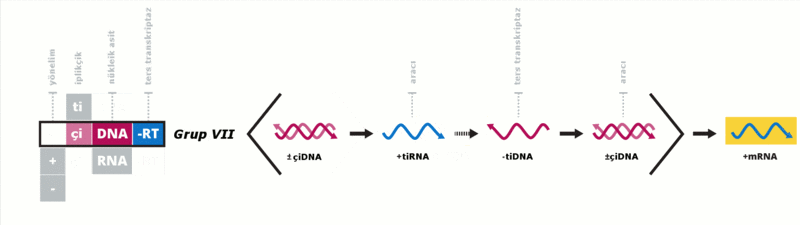
Baltimore sınıflandırması viral mRNA sentezini temel alan bir sınıflandırmadır Virüsler genelde genomlarıyla sentez ettirdikleri proteinleri kullanarak kendilerini replike ettirirler. Viral genom çift iplikçikli (çi) veya tek iplikçikli (ti) olabileceği gibi DNA ya da RNA da olabilir, bazı virüslerde ters transkriptaz enzimi varken bazılarında da bu enzim yoktur. Ek olarak tiRNA virüsleri pozitif yönelimli ya da negatif yönelimli olabilirler, pozitif yönelimli virüslerin genomlarına enfektif genom denmektedir. Bu sınıflandırma virüsleri yedi gurupta toplamıştır:
Bu guruplar aşağıdaki gibidir:
|
 |
Yaşamsal özellikleri
Virüslerin bir yaşam biçimi olup olmadığı ya da canlı organizmalarla etkileşime girip girmedikleri konusunda farklı görüşler mevcuttur. Virüsler "yaşamın kıyısındaki organizmalar" olarak tanımlanmışlardır,[8] genler, doğal seçilim yoluyla evrim, ve öz-montaj yoluyla kendilerinin birden çok kopyasını yeniden oluşturarak organizmalardakine benzer özelliklere sahiptir. Genleri olmasına rağmen, genellikle yaşamın temel birimi olarak görülen bir hücresel yapıya sahip değillerdir. Virüsler kendi metabolizmalarına sahip değillerdir ve yeni ürünler üretmek için konak hücrelere ihtiyaç duyarlar. Bu yüzden konak hücre dışında replike olamazlar Rickettsia ve chlamydia gibi bakterilerde konak hücrelerde çoğalabilir olmalarına rağmen canlı olarak kabul edilirler. Canlı kabul edilen hücrelerin çoğalmak için hücre bölünmesini kullanmaları, buna karşın virüslerin hücrelerde spontan olarak replike olmaları onların çoğalmasını canlı kabul edilen hücrelerin çoğalmasından ayırırken virüslerin, çoğalırken doğal seçilime maruz kalmaları nedeniyle genetik yapılarında meydana gelen farklılıklar, onları kristallerin özerk çoğalmasından ayırır. Konak hücrede virüs replikasyonunun, hayatın kökeni çalışmalarına katkısı vardır ve hayatın, moleküllerin kendiliğinden birleşmesi ile başlamış olabileceğini savunan hipoteze katkıda bulunabilir.[1]
Yapıları

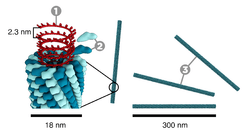
Virüsler morfoloji denilen şekil ve boyutları bakımından farklılıklar gösterirler. Genellikle bakterilerden çok küçüktürler. İncelenen virüslerin çoğunluğu 20 ila 300 nanometre çapa sahiptirler Bazı filovirüslerin çapları yaklaşık 80 nm iken uzunlukları toplamda 1400 nm'ye kadar çıkmaktadır. Çoğu virüs optik mikroskopla görülemez, bu yüzden taramalı ve geçirimli elektron mikroskobu virionları görselleştirmek için kullanılır. Virüs ile arka plan arasındaki kontrastı arttırmak için, elektron - yoğun " boyama" kullanılır. Bu boyalar tungsten gibi ağır metallerden yapılmış tuz solusyonlarıdır, bu boya ile boyanmış yerler elektonla kaplanır. Virionlar boya ile kaplandığında (pozitif boyama), ince ayrıntılar belirsizleşir. Negatif boyamada sadece arka planın boyanması ile bu sorun giderilebilir.
Bir virüs türüne özgü yapıların tümünü bir arada bulunduran tek bir virüs partikülüne virion denmektedir. Viral genom tarafından kodlanan ve kapsomer adı verilen alt ünite proteinlerin bir araya gelmesiyle kapsid oluşmuştur ve kapsidin şekli virüsun morfolojik ayrımında kullanılır. Virüsler konak hücre zarından kendilerine "zarf" adı verilen ve kapsidi çevreleyen lipit bir dış zar oluşturabilirler. Virüs tarafından kodlanan protein alt-üniteleri özerk olarak birleşerek, içinde genellikle virüs genomunu barındıran kapsidi oluştururlar. Kapsid yapılarına yardımcı proteinler için virüslerde karmaşık kodlar vardır. nükleik asit ile ilgili proteinler nükleoproteinler şekilde bilinmektedir ve viral nükleik asit ile viral kapsid proteinlerinin birlikte bulunduğu yapı nükleokapsid olarak adlandırılır. Kapsid ve tüm virüs yapısı atomik kuvvet mikroskobu aracılığıyla mekanik (fiziksel) olarak derinlemesine incelenebilir. Genel olarak, dört ana morfolojik virüs türü vardır:
Virüs morfolojileri
Virüslerin morfolojilerini çeşitli faktörler etkilemektedir, bunların en önemlisi kapsid ve zarf yapılarıdır.
- Sarmal simetri
- Bu virüsler, merkezinde bir oyuk veya tüp olacak şekilde sarmal simetri meydana getiren ve bir eksen etrafında birleşmiş tek tip kapsomerlerden oluşur. Bu düzen, çubuk veya lif şeklinde virionlarla sonuçlanır: Bu virionlar kısa ve son derece sert ya da uzun ve çok esnek olabilir. Genetik materyal genellikle tek iplikçikli RNA'dır fakat bazılarında tek iplikçikli DNA bulunur. Negatif yüklü nükleik asitler, pozitif yüklü proteinlerin etkileşimi ile protein sarmalın içine girer. Genel olarak virion uzunluğu nükleik asidin çapına ve virion çapı ve dizilimine bağlıdır. İyi çalışılmış tütün mozaik virüsü bir sarmal virüs örneğidir.[38]
- Kübik simetri
- Bir çok hayvan virüsü kübik ya da küresele yakın kiral ikozahedral simetridedirler. Özdeş alt birimlerden kapalı bir kabuk oluşturmanın en iyi yolu düzenli bir ikozahedron yapısıdır. Bu yapıda her biri beş özdeş alt birimden oluşan asgari 12 adet özdeş kapsomer gereklidir. Rotavirüs gibi birçok virüs, 12'den fazla kapsomer bulundurur ve küresel görünmelerine rağmen kübik simetrilerini korurlar. Kapsomerlerin uçlarını kuşatan ve pentamer adı verilen 5 diğer kapsomerle çevrilidir. Kapsomerlerin üçgen yüzeylerini kuşatan hekzonlar adı verilen.[39] Hexons are in essence flat and pentons, which form the 12 vertices, are curved. The same protein may act as the subunit of both the pentamers and hexamers or they may be composed of different proteins.
- Yayvan simetri
- Bu beş katlı eksen boyunca uzatılmış ve bakteriyobaj başlarının genel bir düzenidir. Bu yapı her iki ucunda silindirik bir kapatan oluşur.[40]
- Karmaşık simetri
- Bu virüsler ne tamamen sarmal ne tamamen kübik bir kapside sahiptirler ve kuyruk ya da dış duvar gibi ek yapılara sahiptirler. Bazı bakteriyofalar, Enterobacteria faj T4 gibi ikozahedrak bir baş, sarmal bir kuyruk, altıgen taban bir plağı ve çıkıntılı protein kuyruk fibrillerinden oluşan karmaşık bir yapıya sahiptir. Bu kuyruk yapısı moleküler şırınga gibi davranır, virüsun konak bakteriye tutunmasından sonra hücreye virüs genomunu enjekte eder. Yeni araştırmalarda viral genomun fajın baş kısmına basınçla sıkıştırıldığı ve faj konağa tutunduktan sonra basınçla konağın içine fışkırdığı düşünülmektedir bu nedenle enjeksiyon yerine ejeksiyon terimini kullanmaktadır.
 Sarmal simetrili virüs şeması. |  Kübik simetrili virüs şeması. | 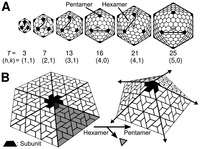 Kapsit proteinlerinin yapısı virüs izolasyonunda önem taşımaktadır. | 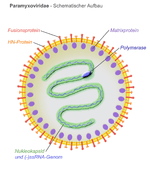 Yayvan simetrili virüs şeması |  Karmaşık simetrili bir bakteriyofaj şeması |
Poksvirüsler büyük, karmaşık yapılı, alışılmadık morfolojiye sahip virüslerdir. Viral genom nukleoid olarak bilinen merkezi disk yapısında proteinlerle ilişkilidir; Nükleoid zar ve işlevi bilinmeyen iki adet yanal protein kütlesinden oluşur; Virüs protein yoğun bir tabaka ile çivili dış zara sahiptir; Tam virion oval bir tuğlaya benzeyen pleomorfik yapıya sahiptir. Mimivirüsler, 400 nm'lik kapsid çapları ile en geniş karakterdeki virüslerdendir, yüzeyden çıkan 100 nm boyutlarında iplikçikleri vardır; Kapsid muhtemelen ikozahedral yapıda olduğundan elektron mikroskobu altında altıgen şekilde görünür. 2011'de, araştırmacılar Şilinin Las Cruces kıyılarından toplanan okyanus dibinden alınan su örneklerinde bilinen en uzun virüs örneğini keşfettiler; Bazik optik mikroskopla görülenebilen bu virüsa geçici olarak Megavirüs chilensis adı verildi. 2013'te, Şili ve Avustralyada Megavirüs ve Mimivirüs'tan iki kat daha büyük genoma sahip Pandoravirüs cinsi keşfedildi.
Arkeleri enfekte eden bazı virüsler diğer virüs şekillerinden bağımsız, iğ, çengel, çubuk, gözyaşı ve hatta şişe şeklinde çok çeşitli sıradışı şekillerde kompleks yapıya sahiptirler. Kuyruklu bakteriyofajlara benzer ve çoklu kuyruk yapıları barındırabilen diğer arke virüsler de vardır.
Genomları
| Özellik | Karakteristik özellik |
|---|---|
| Nükleik asit |
|
| Biçim |
|
| İplikçik yapısı |
|
| Anlam |
|
Genetik yapıların en muazaam çeşitleri virüs türleri arasında görülebilir; virüsler, bitkilerden, hayvanlarden, arkelerden ya da bakterilerden daha fazla genomik çeşitlilik barındırırlar. Yaklaşık 5.000 tür detaylı bir şekilde tarif edilmiş olmasına rağmen, farklı türde milyonlarca virüs mevcuttur.[3][4] Eylül 2015 tarihi itibariyle, NCBI Virüs Genomu Veritabanı 75.000 'den fazla tam genom dizisine sahiptir,[41] kuşkusuz daha keşfedilmeyi bekleyen birçok çeşidi mevcut.
Bir virüs DNA ya da RNA'dan sadece birini barındırabilir ve bu sebeple DNA veya RNA virüsu olarak adandırılır. Virüslerin büyük çoğunluğu RNA genomlarına sahiptir.
Viral genom polyomavirüslerdaki gibi dairesel ya da adenovirüslerdeki gibi doğrusal olabilir. Nükleik asit türünün genomunun şekliyle alakası yoktur. RNA virüsleri ve bazı DNA virüsleri arasında genomu bir kaç parçadan oluşmuş olanlar vardır, bu şekilde genoma sahip virüslera parçalı (segmentli) genoma sahip virüsler denir. RNA virüsleri için, her segment sadece bir protein kodlar ve genelde tüm segmentler aynı kapsidin içinde bulunur. Ancak, brom mozaik virüsü ve diğer çeşitli bitki virüslerinde olduğu gibi virüsun enfektif olması için her segmentin aynı virionda bulunmasına gerek yoktur.
Bir viral genom, nükleik asit türü ne olursa olsun tek veya çift sarmallı olabilir. tek şeritli genomları çiftlenmemiş bir nükleik asitten oluşmaktadır, ortadan aşağı bölünmüş bir merdivenin yarısına benzer şekildedir. Çift sarmallı genomlar birbirini tamamlayan nükleik asit çiftlerinden oluşur. Bazı virüs ailelerinin virüs partikülleri, Hepadnaviridae ait olanlar gibi kısmen çift iplikçikli ve kısmen tek iplikçikli olan bir genom içerebilirler.
Bazı RNA virüsleri pozitif yönelimli (pozitif polariteli), bazıları ise negatif yönelimli (negatif polariteli) virüsler olarak sınıflandırılır. Pozitif yönelimli viral RNA, viral mesajcı RNA ile aynı yönelimdedir ve böylece konak hücre tarafından kolayca okunabilir. Negatif yönelimli RNA virüslerinin RNA'sı viral mRNA'nın tamamlayıcısıdır ve RNA'ya bağımlı RNA polimeraz enzimine gereksinim duyarlar.
Genom boyutu türler arasında büyük ölçüde değişir. En küçük viral genom – the tek iplikçikli DNA'ya sahip circovirüslerdir, Circoviridae ailesi– sadece iki proteini kodlar ve genom boyutu sadece iki kilobazdır;[42] en büyük genom ise pandoravirüslerdedir–genom boyutu 2500e yakın proteini kodlayan iki megabaz civarındadır.[43]
Genelde, RNA virüslerı DNA virüslerinden daha küçük genoma sahiptirler çünkü RNa virüs replikasyonunda daha yüksek oranda hata yapılır ve bu hataların azami üst sınırı vardır. Kopyalanan genomdaki bu sınırın ötesinde yapılan hatalar nedeniyle virüs inaktif olur ya da rekabet yeteneğini kaybeder. Bunu telafi etmek için, RNA virüslerı parçalı genoma sahiptirler. Genom daha küçük moleküller halinde bölünür, bu sayede tek bileşenli genomunda oluşacak bir hatanın tüm genomu etkisiz hale getirmesi olasılığı azaltılır. Tersine, DNA virüslerinin replikasyon enzimleri yüksek oranda doğruluğa sahip olduklarından genellikle daha büyük genomlara sahiptirler. Tek sarmallı DNA virüsleri bu kuralın dışındadırlar, mutasyon oranları tek iplikçikli RNA virüslerine yakın b,ir oranda seyredebilir.
Kapsid
Virüslerin yönetici molekülünü (genomunu) oluşturan DNA veya RNA'yı ve kor proteinlerini çevreleyerek dış etkilerden korur. Kapsit ayrıca virüse şeklini verir, kapsitteki proteinler virüsün hücreye tutunmasını sağlar ve dolayısıyla konak özgüllüğünü belirler.
Viral zarf
- Bazı virüs türleri konak hücrenin zarlarından birisini modifiye ederek kendilerine bir dış zar oluştururlar, bu zar enfekte konak hücreyi çevreleyen zar, çekirdek zarı ya da endoplazmik retikulum gibi iç veya dış zar olabilmektedir. böylece virüs viral zarf denen çift tabakalı lipid zar kazanmış olur. Bu zarda viral genom ve konak hücre genomu tarafından kodlanan proteinler mevcuttur; lipid yapılar ve bazı karbonhidrat yapılarının tamamı zaten ilgili zarda bulunur ve konak hücre genomu tarafından kodlanır. Grip virüsü ve HIV bu stratejiyi kullanırlar. Zarflı virüslerin enfektivitesi zarflarının varlığına bağlıdır ve zarf yapıları zarar gördüğünde inaktif olurlar.[44]
Replikasyon döngüsü
|
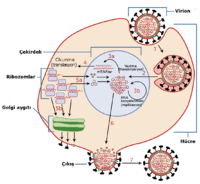
Virüs nüfusu hücre bölünmesi yoluyla artmamaktadır çünkü virüsler birer hücre değillerdir. Bunun yerine, kendilerinin birden fazla kopyasını üretmek için bir konak hücrenin organellerini, moleküllerini ve metabolizmasını kullanırlar, konağa kendi parçalarını kopyalattırıp bu parçaları yine konakta birleştirirler.
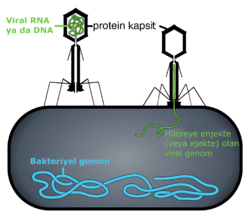
Virüslerin hayat döngüleri türlere göre farklılık gösterse de genelde altı temel aşamada gerçekleşir:[45]
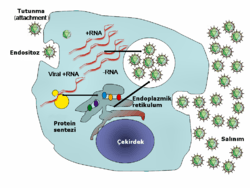
Tutunma
Konak hücre yüzeyindeki reseptörlerle viral kapsid üzerindeki veya viral zarf üzerindeki proteinlerin özgül (spesifik) bağlanması ile gerçekleşir. Bu özgüllük bir virüsün konak aralığını belirleyen faktörlerdendir. Örneğin, HIV'in konak aralığı insan akyuvar hücreleri ile sınırlıdır. Bunun nedeni HIV yüzey molekülü gp120, özgül olarak CD4 molekülü ile etkileşime girer ve CD4 molekülü sıklıkla CD4+ T-Hucrelerinde bulunur. Virüs konak hücreye tutunduktan sonra, konak hücre yüzeyinde çeşitli değişiklikler olur.
Hücreye giriş
- Konu hakkında ayrıntılı bilgi için Viral giriş maddesine bakınız.
Tutunmayı takip eder: Virion, reseptöre bağımlı endositoz ya da füzyon yolu ile konak hücreye girer. Bu genellikle viral giriş olarak adlandırılır. Bitki ve mantar hücrelerinin enfeksiyonu hayvan hücrelerininkinden farklıdır. Bitkiler selüllozdan ve mantarlar kitinden yapılmış sert bit hücre duvarına sahiptirler, çoğu virüs bitki ve mantarları hücre duvarlarının hasar görmesi sonucu enfekte eder.[46] Ancak, neredeyse tüm bitki virüsleri (tütün mozaik virüsü gibi) tek iplikçikli nükleoprotein komplekslerinin içerisinde, plazmodezmata adlı gözenekler boyunca hücreden hücreye direkt olarak hareket ederler.[47] Bakteriler de bitkiler gibi güçlü hücre duvarına sahiptirler. Ancak, bakteriler bitki hücrelerinden küçük oldukları için hücre duvarlarıda bitkilerinkine göre çok daha incedir, Bazı virüsler genomlarını bakteriye enjekte edecek mekanizmalar geliştirmişlerdir, bu işlemde viral kapsid hücre dışında kalır.
Kapsidin soyulması
Viral kapsidin çıkartıldığı bir işlemdir: Bu işlem viral enzimler ya da konak enzimleri tarafından veya kapsidin basit ayrışma ile bozulmasıyla oluşabilir; sonuç olarak viral nükleik asit hücre içinde serbest kalır.
Viral replikasyon (kopyalanma)
- Konu hakkında ayrıntılı bilgi için Virüs replikasyonu maddesine bakınız.
Virüs genomunun birincil çoğalmasını kapsar. Replikasyon, "erken" genlerden viral mRNA'nın sentezi (mRNA) (pozitif yönelimli virüsler için istisnadır), viral protein sentezi, viral proteinlerin olası birleşmeleri, erken veya düzenleyici olarak nitelendirilen proteinlerin aracılığıyla viral genomun replikasyonu aşamalarını kapsar. büyük genomlu kompleks virüslerde mRNA sentezinde bir veya daha fazla aşama olabilir.
Birleşme
Viral ürünlerin bir araya gelerek birleşmesi ve progeni virüslerinin oluşması aşamasıdır, bu aşamada proteinlerde çeşitli değişiklikler meydana gelebilir. HIV gibi virüslerde, bu değişiklikler (olgunlaşma da denilmektedir) virüs konaktan salınmadan önce meydana gelir.
Salınma
- Konu hakkında ayrıntılı bilgi için Viral çıkış maddesine bakınız.
Virüsler konak hücreden lizis yoluyla salınabilirler, lyzis hücre zarı veya duvarının patlaması ile hücrenin ölmesi olayıdır. Pek çok bakteri virüsü ve bazı hayvan virüsleri bu yolla salınır ve bu tür enfeksiyonlara "litik enfeksiyon" denir. Bazı virüslerin viral genomu genetik rekombinasyon yoluyla konak kromozomunun özgül bir bölgesiyle birleşerek lizojenik döngüye girerler. Bu şekilde birleşmiş virüs genomlarına "provirüs", bakteriyofaj genomlarına ise "profaj" denmektedir.[48] Bu birleşme olayına "lizojeni" ade verilirken, buna maruz kalan konağa da "lizojen" denir. Lizojen konak bölündükçe viral genom da çoğalır. Viral genom konak içinde çoğunlukla sessizdir. Bunun yanında bazı durumlarda provirüs ya da profaj entegre olduğu yerden ayrılabilr ve litik enfeksiyona yol açabilir.[49] Zarflı virüsler (örneğin HIV) tipik olarak tomurcuklanarak konak hücreden salınır. Bu işlem sırasında virüs konağın plazma zarından ya da diğer iç zarlarından modifiye edilmiş bir zarla kendi zarfını elde eder.[50]
Virüs partikülleri içindeki genetik malzemeler, ve bu malzemelerin çoğaltılması, farklı virüslerda önemli ölçüde farklılıklar göstermektedir.
- DNA virüsleri
- Bir çok DNA virüsünün genom replikasyonu konak hücre çekirdeğinde meydan gelir. Virüsler bazen füzyon ile çoğu zaman da reseptöre bağımlı endositoz yoluyla hücreye girrler. Çoğu DNA virüsü baştan sona konak hücre DNA ve RNA sentez meanizmalarına bağımlıdırlar. Ancak daha büyük genoma sahip virüsler bu mekanizmaları kendileri kodlayabilirler. Ökaryotlarda viral genom bu mekanizmalara ulaşabilmek için hücre çekirdeğine girmesi gerekirken, bakterilerde sadece hücre içine girmesi yeterlidir.[51]
- RNA virüsleri
- Replikasyon genellikle konak hücre sitoplazmasında meydana gelir. RNA virüsleri replikasyon modellerine göre dört farklı guruba ayrılabilirler. Tek iplikçikli RNA virüslerinin yönelimi (polarite) büyük ölçüde replikasyon modellerini belirler (kendi proteinlerini üretebilmek için ribozomları direk kullanıp kullanamadıkları); diğer önemli bir kriter genetik malzemenin tek iplikçikli veya çift iplikçikli olup olmadığıdır. Tüm RNA virüsleri genomlarını kopyalayabilmek için için kendi RNA replikaz (RNA'ya bağımlı RNA polimeraz) enzimleri kullanırlar.
- Ters transkripsiyonlu virüsler
- Virionlarında tek iplikçikli RNA bulunduran (Retroviridae, Metaviridae, Pseudoviridae) ya da çift iplikçikli DNA bulunduran (Caulimoviridae ve Hepadnaviridae). Ters transkripsiyon yapan RNA virüsleri replike olmak için bir ara DNA kullanırlar, buna karşılık ters transkripsiyon yapan DNA virüsleri (pararetrovirüses) replike olmak için bir ara RNA kullanırlar. Her iki virüs gurubu da nükleik asit dönüşümünü gerçekleştirmek için ters transkriptaz enzimi kullanırlar. Retrovirüslerin provirüs gibi konak hücre DNA'sına entegre olmaları, replikasyon stratejilerinin bir parçasıdır; pararetrovirüslerin bunu yapmamalarına rağmen özellikle bitki pararetrovirüslerinin entegre genom kopyaları enfektif virüslerin ortaya çıkmasına neden olabilir. Ters transkriptaz enzimi zidovudine ve lamivudine gibi antiviral ilaçlara duyarlıdır. Birinci örnek bir retrovirüs olan HIV. İkinci örnek ise Hepatitis B virüsunun içinde bulunduğu Hepadnavirüsler.[52]
Viruslar arası ilişkiler
Genetik mutasyon
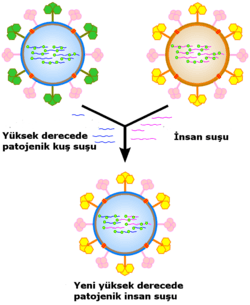
Virüsler birçok mekanizma ile genetik materyal değişikliğine uğrayabilirler. Antijenik kayma adı verilen işlemleride içeren DNA ya da RNA bazlarının tek tek diğerleri ile mutasyona uğramasıdır. Birçok nokta mutasyon "sessizdir" – sessiz mutasyonlar protein kodlayan genlerde değişime neden olmazlar – fakat örneğin antiviral ilaçlara karşı direnç geliştirebilen diğer mutasyonlardaki gibi, evrimsel avantajlara da neden olabilirler. Antijenik sapma virüs genomunda köklü değişikliklere neden olur; Bu değişiklikler rekombinasyon ve reassortmanın bir sonucudur; İnfluenzavirüslerde meydana gelirken pandemilere neden olur. RNA virüsleri çoğu kez quasispecies (çeyrek tür) ya da aynı türden virüs gurupları şeklinde bulunurlar, gurup üyelerinin genom nükleotit dizilerinde farklılıklar bulunabilir. Doğal seleksiyon için birincil hedef quasispecieslerdir.
Parçalı genom evrimsel avantajlar kazandırır; parçalı genoma sahip virüsün farklı suşları, parçalı genomlarını karıştırabilir ve aynı soydan progeni virüsler ya da benzersiz özelliklere sahip yeni virüsler meydana gelebilir. Bu duruma reassortman ya da viral çiftleşme de denir.
Genetik rekombinasyon bir DNA iplikçiğinin kırılıp daha sonra farklı bir DNA molekülünün sonuna birleştirilmesi sürecidir. Virüslerin aynı hücreyi aynı anda enfekte ettiği durumlarda oluşur ve virüs evrimi çalışmaları sırasında çalışılan türler arasında yaygın olarak yapıldığı gözlenmiştir. Rekombinasyon hem DNA hem de RNA virüslerinde meydana gelebilir.
Konak ve konak aralığı
- Konu hakkında ayrıntılı bilgi için Konak özgüllüğü maddesine bakınız.
Parazitik canlıların faydalandığı diğer canlılara konak denir. Virüsler zorunlu parazitlerdir, replikasyon yoluyla çoğalırlar ve replikasyon yapabilmek için konak hücreye gereksinim duyarlar.
Diğerlerini göz önünde bulundurursak virüsler yeryüzünde bugüne kadar en bol biyolojik çeşitliliğe sahip guruptur. Hayvanlar, bitkiler, bakteriler, arkeler ve mantarlar gibi yaşam biçimlerinin her türünü enfekte edebilirler.[3] Bununla birlikte, farklı virüs tipleri bu yaşam biçimlerinin sadece sınırlı bir aralığına bulaşabilir ve virüs enfeksiyonları türe özeldir. Bu özgüllük canlı türü düzeyinde olduğu gibi hücresel düzeyde de olabilir. Örneğin smallpox virüsü sadece insan türünü enfekte edebilir ve dar bir konak aralığı olduğu söylenebilir.[53] Kuduz virüsü gibi bazı virüsler, memelilerin birçok türünü enfekte edebilir ve buvirüslerin geniş bir konak yelpazsesi olduğu söylenebilir.[54] Bitki virüslerinin ve diğer hayvan virüslerinin birçoğu insanları enfekte etmez. Bazı bakteriyofajlar sadece bir bakteri suşunda enfeksiyona neden olurlar ve faj tiplendirilmesi bakteriyel hastalıkların kaynaklarının araştırılmasında kullanılabilen bir yöntemdir.
Konak hücerdeki etkileri
Virüslerin konak hücrede meydana getirdiği yapısal ve biyokimyasal etkiler geniş kapsamlıdır.[55] Bu etkilere sitopatik etkiler denir. Birçok virüs enfeksiyonu sonrası konak hücre ölür. Ölüm nedenleri, hücre parçalanması (lizis), hücrenin sitoplazmik zarındaki değişiklikler ve apoptozis olabilir. Hücre ölümü vakaları sık sık, virüsün yapısına katılan ve katılmayan partiküller özgül proteinler nedeniyle virüsün hücreyi baskılaması sonucu hücrenin normal faaliyetlerinin durmasından kaynaklanır.
Bazı virüsler enfekte hücrede hiçbir belirgin değişikliğe neden olmazlar . Virüsler hücrede sessiz (latent) olarak kalabilirler ve bir kaç belirti dışında hücre normal fonksiyonlarına devam eder. Bu kalıcı (persistan) enfeksiyon vakalarına neden olur ve virüs aylarca hatta yıllarca uykuda kalabilir. Bu vakalar genelde herpes virüs enfeksiyonlarında meydana gelir. Baz virüsler, Epstein–Barr virüsü gibi, habis kanserlere neden olmadan hücre çoğalmasına neden olurlar, Papillomavirüsler gibi bazı virüsler ise kanserlere neden olabilirler.
Konak savunma mekanizmaları
Virüslere karşı vücudun ilk savunma hattı doğuştan gelen bağışıklık sistemidir. Bu konağı enfeksiyondan nonspesifik olarak savunan hücreleri ve diğer mekanizmaları içermektedir. Bunun anlamı doğuştan gelen bağışık sistemi hücrelerinin patojenleri tanıması ve genel bir şekilde onlara cevar vermesidir ancak edinilmiş bağışıklık sisteminin aksine konağa uzun süreli ya da koruyucu bağışıklık sağlamaz.
RNA interferaz virüslere karşı doğuştan gelen önemli bir savunmadır. Birçok virüsün çift iplikçikli RNA (çiRNA) içeren bir replikasyon stratejisi vardır. Böyle bir virüs bir hücreyi enfekte ettiğinde, RNA molekülü ya da moleküllerini salar ve bu moleküller hemen RNA'yı küçük parçalara kesen dicer denilen bir protein kompleksine bağlanırlar sonrasında bir biyokimyasal yol olan RISC kompleksi aktive olur ve viral mRNA'yı yıkımlayarak hücreyi enfeksiyondan korur. Rotavirüsler çift kapsidlidirler ve kapsidleri tam olarak soyulmaz virüsün üretilen mRNA'lar iç kapsidinde bulunan gözeneklerden salınırlar ve bu sayede RISC kompleksi aktive olmaz. Böylece rotavirüsün çift iplikçikli RNA'sı kapsid içinde zarar görmeden kalır.
Omurgalıların edinilmiş bağışıklık sistemi bir virüsle karşıaştığında, virüse bağlanan ve genellikle enfeksiyon yapma özelliğini ortada kaldıran özgül antikorlar üretirler. Buna humoral ya da sıvısal immün yanıt denir. Antikorların iki önemli tipği vardır. Birincisi IgM denen ve virüs nötralizasyonunda oldukça etkili bir antikordur ancak hücreler tarafından sadece bir kaç hafta boyunca üretilirler. İkincisine ise IgG denir ve süresiz olarak üretilir. Konakçı kanında IgM varlığı akut enfeksiyonların tanımlanmasında kullanılır, bunun yanında IgG varlığı geçmiş bir zamanda deçirilmiş bir enfeksiyona işaret eder. Bağışıklık testlerinde ise IgG'ye bakılır.
virüsler konak hücreye girdikten sonra da antikorlar etkili bir savunma mekanizması olmaya devam edebilir.
Omurgalılardaki ikinci savunma mekanizması hücresel immunitedir ve T hücreleri olarak bilinen savunma hücrelerini içerir. Bir T hücresi vücuttaki hücrelerin yüzeylerindeki proteinlerin kısa bölümlerini gözlemler ve şüpheli bir durumla karşılaşırsa öldürücü T hücreleri hücreyi yıkımlar, eğer yıkımlanan hücrede virüs enfeksiyonu var idiyse bu sefer virüse özgül T hücreleri çoğalır. Makrofajlar gibi hücreler bu antijen sunumunda uzmanlaşmıştır. İnterferon üretimi önemli bir konak savunma mekanizmasıdır, interferon virüs mevcudiyetinde vücut tarafından üretilen bir hormondur. Bağışıklıktaki rolü karmaşıktır; enfekte hücreyi ve komşularını öldürerek enfeksiyonun yayılmsına mani olur.
Tüm virüs enfeksiyonlarında bağışıklık cevabı oluşmayabilir. HIV virion yüzeyindeki amino asit dizilimini sık sık değiştrerek bağışıklık sisteminden kaçar. "kaçış mutasyonu" olarak bilinen bu durumla birlikte viral epitoplar konak bağışıkık mekanizmalarından kaçar. Bu kalıcı virüsler antijenik sapma ile beraber konak bağışıklık sisteminin enfeksiyonu sınırlandırmasını engellerler, antijen sunumunu bloke ederler, sitokine direnç sağlarlar, doğal öldürücü hücrelerin faaliyetlerinden kaçarlar, apoptozisten kaçarlar. Nörotropik virüsler denen başka diğer virüslerde sinirler boyunca yayıldıkları için bağışıklık sistemi elemanları bunlara ulaşamayabilir.
Epidemiyoloji
Viral epidemiyoloji virüslerin yayılımı ve kontrolünü ele alan bir tıp dalıdır. Virüsler anneden-bebeğe dikey (vertikal) yolla yayılablecekleri gibir, insandan insana yatay (horizontal) yolla da yayılabilirler. Dikey yolla bulaşmaya hepatit B virüsü ve HIV örnek verilebilir, bebek doğduğunda çoktan bu virüslerle enfekte olmuştur. Daha nadir görülen başka bir örnek varicella zoster virüsudur, yetişkinlerde hafif seyreden enfeksiyonlara neden olurken ceninde ve yeni doğanlarda öümcül enfeksiyonlara yol açabilir.
Yatay yolla yayılma virüs populasyonunun sürdürülmesinde daha çok karşılaşılan bir bulaş yoludur. virüsler: seksüel aktivite sırasında temas edilen vücut sıvıları gibi maddelerden bulaşabilir. Örneğin, kontamine transfüzyon çözeltileri ya da aletleri ile kan yoluyla HIV bulaşabilir; hepatit C; Ağız sagısıyla bulaşabilir; Epstein–Barr virüsü; Kontamine gıda veya su tüketimi ile bulaşabilir; virüs içeren aerosoller solunduğunda norovirüsler buşabilirken, damlacık enfeksiyonu ile influenza virüs bulaşabilir; Deng hummasında olduğu gibi sinekler ve böcekler gibi vektörler ya da konaklar ile bulaşabilir. Viral enfeksiyonların yayılma oranı ya da hızı nüfus yoğunluğunu ve duyarlı kişilerin nüfustaki oranı, yaşam kalitesi ve iklim şartları gibi faktörlerin de içinde bulunduğu bazı faktörlere bağlıdır.
Epidemiyoloji, viral hastalıkların salgınları sırasında hayat çemberini kırmak için kullanılır.[56] kontrol önlemleri virüsün nasıl bulaştığı sorusunun ceabına göre alınır. Salgının kaynağını veya kaynaklarını b ulmak için virüsün tespiti önemlidir. Tespit edilen virüsün yaılımı aşılamalar yoluyla engellenebilir. Mevcut aşısı bulunmayan virüsler içinse, sanitasyon ve dezenfeksiyon etkili önlemler olabilir. Sık sık, enfekte kişiler toplumun geri kalanında ayrı tutulurlar ve virüse maruz kalmış olanlar karantinada tutulurlar.[57] 2001 yılında İngilterede şap hastalığı salgınının kontrol altına alınması çalışmalarında yüzlerce sığır itlaf edildi.[58] İnsan ve hayvanlarda meydana gelen viral enfeksiyonların çoğunda kuluçka süresince herhangi bir belirti meydana gelmez. Çoğu viral hastalık için bilinen kuluçka süreleri bir kaç günden bir kaç haftaya kadar değişebilir. İnsanlar ya da hayvanlar enfekte olduklarında kontajiyöz olarak diğer insanlara ve hayvanlara enfeksiyonu belaştırdıkları, genel olarak kuluçka dünemini takip eden bir yayılım dnemi vardır. Birçok viral enfeksiyon için bilinen bu dönemlerin bilinmesi, salgınların kontrolünde çok önemlidir.[59] Bir popülasyonda, toplulukta, ya da bölgede hastalık vakalarının alışılmadık derecede yüksek oranda olması durumuna epidemi denir. Salgınlar dünya çapına yayıldıysa bunlara pandemi denir.[60]
Epidemiler ve pandemiler
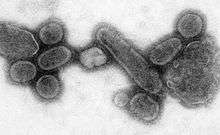
Amerkan yerlileri kontajiyöz hastalıklar nedeniyle harap olmuş durumda idiler, özellikle de avrupalı sömürgeciler tarafından getirilen çiçek hastalığı nedeniyle. Colomb'un amerikaya ayak basmasından öne kaç tane yerlinin aşina olmadıkları hastalıklardan öldüğü bilinmemektedir, ancak rakamların yerli nüfusunun %70'ine yakın olduğu tahmin edilmiştir. Bu hastalıkların yerlilere verdikleri zararlar önemli ölçede avrupalıların istilalarına yardımcı olmuştur.[61]
Dünya çapındaki epidemilere pandemi denir. 1918 grip pandemisi, 1919 yılına kadar devam etti,kategori 5 influenza pandemisi influenza A virüsünün neden olduğu ciddi alışılmadık ciddi ve ölümcül hastalıklara neden olmuştur. Birçok grip salgınında ağırlıklı olarak, çocuklar yaşlılar ve bağışıklığı zayıf kişiler etkilenirken, kurbanlar genellikle sağlıklı genç yetişkinler olmuştur. Eski tahminlere göre 40-50 milyon insanın öldüğü tahmin edilmektedir, daha yeni tahminlerde ise etkilenip bir şekilde ölen insanların 100 milyonu bulduğu belirtilmektedir ve bu rakam 1918 de ki dünya nüfusunun %5'idir.
Birçok araştırmacı HIV'in 20. yüzyılda Sahra Altı Afrika'da ortaya çıktığını olduğunu düşünmektedir; Şu anda pandemik olan bu etkenin neden olduğu hastalıkla dünya çapında tahminen 38.6 milyon insan yaşamaktadır. HIV/AIDS Hakkında Ortak Birleşmiş Milletler Programı (UNAIDS) ve Dünya Sağlık Örgütü (DSÖ) AIDS'in ilk tanımlandığı 5 Haziran 1981 yılından bu yana 25 milyon insan öldü ve kaydedilen en yıkıcı pandemilerden birine neden oldu. 2007'de 2.7 milyon insan HIV ile enfekte olmuştur ve 2 milyon insan HIV ile ilşkili enfeksiyonlardan dolayı ölmüşlerdir.
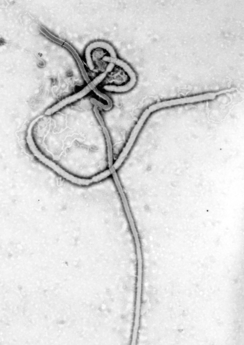

Ciddi manada ölümcül etkenlerin yer aldığı Filoviridae ailesi. Filovirüsler ebolavirüsleri ve marburg virüsleri barındırır, iplik benzeri virüslerdir ve viral kanamalı hummalara neden olurlar. Marburg virüsü, 1967'de tespit edildi, 2005'de Angola'da meydana gelen salgın basının dikkatini çekmişti. Ebola Virüs Hastalığı ilk tanımlanığı 1976 yılından bu yana yüksek oranda ölümlerle seyreden aralıklı salgınlara neden oldu. En kötü ve en yakın zamanda meydana gelen salgın Batı Afrika Ebola salgınıdır.
Korunma ve tedavi
virüsler konak hücrede hayati metabolik yolları kullandıkları için, genel olarak konak hücrede toksik etkilere neden oan ilaçlar kulanılmak durumundadır. Viral hastalıklarda en etkili medikal yaklaşım enfeksiyona bağışıklık sağlamak aşılama yapmak ve seçici olarak viral replikasyonu engelleyen antiviral ilaçlardır.
Aşılama
- Konu hakkında ayrıntılı bilgi için Aşılama maddesine bakınız.
Aşılama virüs enfeksiyonlarından korunmada etkili ve ucuz bir seçenektir. Aşı uygulamaları virüslerin keşfinin de öncesinde uygulanmakta idi. Aşılamanın keşfi çocuk felci, kızamık, kabakulak ve kızamıkçık gibi hastalıkların morbiditeleri (hastalık) ve mortalitelerinde (ölüm) dramatik bir düşüşe neden olmuştur. Çiçek hastalığı enfeksiyonları eradike edilmiştir. Aşılamalar insanlarda halihazırda 13'ün üzerinde viral enfeksiyonun önlenmesinde ve daha fazlası hayvanlardaki viral enfeksiyonların önlenmesinde kullanılmaktadır. Aşılar viral proteinleri ya da zayıflatılmış veya öldürülmüş virüsleri (antijenler) içerebilir. Virüslerin zayıflatılmış (attenüe) formlarını içeren canlı aşılar, hastalığa neden olmazlar ancak yine de bağışıklık sağlarlar. Canlı aşılar, bağışıklık sistemi zayıf insanlarda tehlikeli olabilirler çünkü bu insanlarda virüs zayıflatılmış bile olsa hastalığa yok açabilir. Biyoteknoloji ve genetik mühendisliği teknikleri alt ünite aşıların üretilmesi için kullanılmıştır. Bu aşılar sadece virüsün kapsid proteinlerinden yapılmaktadır. Hepatit B sşısı bu aşılara bir örnektir. Alt ünite aşıları bağışıklık sistemi zayıf insanlarda güvenle kullanılabilirler çünkü hastalığa neden olmazlar. Sarı humma virüsü aşısı, 17D olarak bilinen canlı-attenüe bir suştur, muhtemelen üretilen en güvenli ve etkili aşıdır.
Antiviral ilaçlar
- Konu hakkında ayrıntılı bilgi için Antiviral ilaç maddesine bakınız.
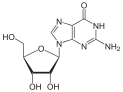
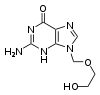
antiviral ilaçlar genellikle virüslerin yanlışlıkla kendi genomları ile birleştirdiği nükleosit analoglarıdır (Sahte DNA yapıtaşı). Virüsün yaşam döngüsü durdurulur çünkü yeni sentezlenen DNA inaktiftir. Örneğin herpes simpleks virüs enfeksiyonları için kullanılan bir nükleosit analoğu olan asiklovir ve HIV ve hepatit B virüs enfeksiyonlarında kullanılan lamivudin. Asiklovir en eski ve en sık reçete edilen antiviral ilaçların biridir. Kullanılan diğer antiviral ilaçlar virüs yaşam döngüsünün çeşitli evreleri hedefler. HIV, enfeksiyöz forma geçebilmek için HIV-1 protease denilen proteolitik bir enzime gereksinim duyar. Bu enzimi inaktive etmek için proteaz inhibitörleri adı verilen geniş bir ilaç gurubu vardır.
Hepatit C'ye neden olan RNA virüslerinin oluşturduğu enfeksiyonların %80'i kronik seyirlidir ve hastalar tedavi edilmezlerse karaciğerlerinin kalan kısımları da enfekte olur, etkili bir tedavi için interferon ile kombine şekilde nükleozid analogu bir ilaç olan ribavirin kullanılır. Benzer bir strateji kullanarak, kronik hepatit B taşıyıcılırını tedavi etmek için lamivudine geliştirilmiştir.
Tespit, saflaştırma ve tanı
Laboratuvarda virüsleri çoğaltma ve tespit etmek için çeşitli yöntemler vardır. Kültürlenmiş hücreler bir virüsle enfekte edildikten sonra ortama salınan virüslerin saflaştırılması için santrifüjleme yöntemleri, amonyum sülfat veya etilen glikol ile çökeltme, veya hücre bileşenlerinin organik çözücülerle arıtılması gibi teknikler kullanılır.
Virüslerin tespiti ve miktarlarının belirlenmesi için kullanılan yöntemler arasında:
- Hemaglütinasyon testi. Bir alyuvar süspansiyonuna virüsler eklenir, alyuvarların kümeleşmesine (aglütinasyonuna) bakılarak virüs sayısı belirlenir. Kümeleşmenin nedeni, virüslerin alyuvarların yüzeyine bağlanarak hücreleri birbirine bağlamalarıdır.
- Elektron mikroskobu ile doğrudan sayım. Derişik bir virüs süspansiyonu, konsantrasyonu bilinen bir mikroskopik bilye süspansiyonu ile karıştırılır ve bu karışım özel bir yüzeyin üzerine damlatılır. Yüksek büyültme altında virüs tanecikleri ve suni bilyeler sayılarak virüslerin konsantrasyonu hesaplanır.
- Plak sayımı. Kültür kaplarında konak hücreler ince bir tabaka halinde büyütülür. Bir virüs süspansiyonu ayrı tüplerde farklı oranlarda seyreltilip bu kaplara eklenir. Her bir virüs tanesi çoğalarak birbirine bitişik çok sayıda hücreyi öldürür, hücre tabakasında bir delik ('plak') oluşmasına neden olur. Plakların sayısından o kaba kaç tane virüs eklenmiş olduğu anlaşılır, buna dayanarak virüs konsantrasyonu hesaplanabilir.
Hastalardan yeni bir hastalığın virüsünün tespiti (yakın geçmişten ebola veya HIV örnekleri verilebilir) ve o virüsün saflaştırılması özelleşmiş laboratuvarlar, ayrıca moleküler biyolog ve virolog gibi uzmanlar gerektirir. Bu genelde devlet laboratuvarlarının gayretleriyle gerçekleştirilir ve zor durumlarda Dünya Sağlık Örgütü gibi kuruluşların yardımını gerektirebilir.
Diğer türlerdeki viral enfeksiyonlar
Virüsler tüm hücresel yaşam formlarını etkilerler, virüsler evrensel etkenler olmalarına karşın kendilerine özgül konaklarda enfeksiyona neden olurlar. Uydu adı verilen bazı virüsler, replike olabilmek için başka virüslere gereksinim duyarlar.
Hayvan virüsleri
Virüsler çiftlik hayvanlarında önemli hastalık etkenlerindendir. Şap (hastalık) (şap) ve mavidil hastalığının etkenleri virüslerdir. Kedi, köpek ve atlar gibi refakatçi hayvanlar aşılanmadıklarında ciddi viral enfeksiyonlarla karşı karşıya kalmaktadırlar. Canine parvovirüs yavru köpeklerde ölüme yol açan enfeksiyona neden olan küçük bir DNA virüsüdür.[62] Tüm omurgasızlar gibi bal arıları da viral enfeksiyonlara oldukça duyarlıdırlar.[63] Birçok virüs ise konaklarında herhangi bir zarara ve belirtiye neden olamada bulunur.[2]
Bitki virüsleri

Bitki virüslerinin birçok tipi vardır. Bu virüsler bitkilerde verim kaybına neden olurlar ancak bunlarla mücadele ekonomik değildir. Bitki virüsleri, genellikle vektörlerolarak bilinen organizmalarla bitkiden bitkiye yayılır. Bunlar normalde böceklerdir ama mantarlar, nematodlar ve tek hücreli organizmalar da olabilir.[64] Bitki hücreleri insanları ya da diğer hayvanları enfekte emezler çünkü sadece canlı bitki hücrelerinde çoğalırlar.[65]
Bitkilerin virüslere karşı ayrıntılı ve etkili savunma mekanizmaları vardır. Bunların en etkilisi direnç varlığını ifade eden direnç (R) genleridir. R genleri enfekte hücrenin etrafında hücre ölümü ile lokalize ve genellikle çıplak gözle görülebilen büyük noktalardan tetiklenir ve her R geni belli bir virüse karşı direnç sağlar. Bu noktalar enfeksiyonun yayılmasını durdurur.[66] RNA interferans bitkilerde etkili bir savunmadır.[67] Bitkiler enfekte olduklarında virüsleri öldürmek için genellikle salisilik asit, nitrik oksit, ve reaktif oksijen molekülleri gibi doğal dezenfektan maddeler üretirler.
Bitki virüsü partikülleri ya da virüs benzeri partiküller (VLPs) ile ilgili biyoteknoloji ve nanoteknoloji çalışmaları vardır. Birçok bitki virüsü kapsidi basit ve dayanıklı yapıdadır ve enfekte bitkiler tarafından çeşitli heterolog sistemlerle çok miktarda üretilirler. Biyoteknolojide kullanılması için bitki virüsleri genetik ve kimyasal olarak modifiye edilip yapılarına yabancı maddeler dahil edilebilmektedir.
Bakteri virüsleri
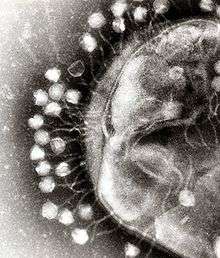
Bakteriyofajlar ile diğer virüslerin ortak ve farklı yönleri vardır ve su ortamlarındaki biyolojik çeşitliliğin en bol formudur – bu virüsler okyanuslarda bakterilerden on kat daha fazladır,[68] bakteriyofajlar deniz suyunun mililitresinde 250.000,00 adede ulaşmıştır.[69] Bu virüsler özgül olarak yüzey reseptör moleküllerine bağlanarak bakteriye girerler ve bakteriyi enfekte ederler. Kısa bir süre içerisinde, bazı vakalarda sadece bir kaç dakikada, bakteriyel polmeraz, protein sentezi yapmak üzere viral mRNA sentezlemeye başlar. Bu proteinler ya hücrede yeni virionların sentezlenmesinde ya viral parçaların birleştirilmesine ya da hücrenin parçalanmasında yardım eder. Viral enzimler bakterinin hücre duvarının parçalanmasını sağlarlar, T4 fajı vakalarında olduğu gibi, sadece yirmi dakika içerisinde bakteriden 300 faj serbest kalır.[70]
Bakterilerin bakteriyofajlara karşı en büyük silahlarıyabancı DNA'yı yıkımlayan enzimlerdir . Bu enzimlere restriksiyon endonükleazları denir ve bakteriye enjekte olan bakteriyofaj DNA'sını keserler.[71] Bakteriler CRISPR sekanslarını kullanan, bakterinin geçmişte temas ettiği virüs genomunu tutan ve RNA interferaz enzimi ile virüs replikasyonunu engelleyen bir sisteme de sahiptirler,[72][73] bu genetik sistem bakteriler açısından edinilmiş bağışıklıktır.
Arke virüsleri
Bazı virüsler arkelerde replike olurlar: Bunlar farklı ve bazen benzersiz şekillere sahip çift-iplikçikli DNA virüsleridir.[5] Bu virüsler termofilik arkelerde ve özellikle Sulfolobales ve Thermoproteales takımlarında daha ayrıntılı olarak incelenmiştir.[74] Bu virüslere karşı savunma mekanizması, virüslerin genleriyle ilişkili arke genomu ile beraber tekrarlayan DNA dizilerinden RNA interferaz içermektedir.[75] Çoğu arkede de adaptif savunma olarak CRİSPR-Cas sistemi mevcuttur.
İnsan hastalıklarındaki rolleri
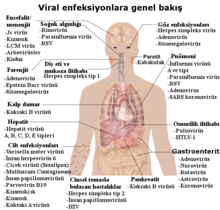
Virüslerin neden olduğu yaygın insan hastalıklarının örnekleri arasında, soğuk algınlığı, grip, su çiçeği ve uçuk yaraları gibi hastalıkların yanı sıra ebola virüs hastalığı, AIDS, tavuk vebası (kuş gribi) ve SARS gibi pek çok ciddi hastalıklar da bulunmaktadır. Virüsün hastalık yapabilme yeteneği virulans olarak adlandırılmaktadır. diğer hastalıkların oluşumunda da virüslerin muhtemel bağlantıları araştırılmaktadır, örneğin insan herpesvirüs 6 (HHV6) nın multipl skleroz ve kronik yorgunluk sendromu gibi sinirsel hastalıklarda rol oynadığı düşünülmektedir. Önceleri bornavirüslerin, atlarda nörolojik hastalıklara ve insanlarda psikiyatrik hastalıklara neden olduğu düşünülmekteydi.
Virüsler virüsün türüne göre değişebilen farklı mekanizmalar ile hastalığa neden olurlar. Hücresel düzeyde etkileri, hücreler parçalanarak ölebilir çok hücreli organizmalarda, yeterli sayıda hücre ölürse, etkiler bütün organizmaya yayılmaya başlar. Bazı virüsler organizmada nispeten zararsız gibi bulunmalarına rağmen hastalık yaparak sağlığın ve homeostazın bozulmasına neden olabilirler. Örneğin herpes simpleks virüsü insanda zararsız şekilde bulunur ancak bağışıklığın baskılandığı durumlarda iktif hale gelerek uçuklara neden olabilir, bu duruma gizli (latent) enfeksiyon denir ve herpes virüslerin karakteristik özelliklerindendir, buna benzer başka virüsler da vardır örneğin Epstein–Barr virüsü glandüler ateşe neden olur, varisella zoster virüsü su çiçeği ve zonaya neden olur. Birçok insan herpesvrusların en az bir türü ile enfektedir.[76] Ancak latent virüsler bazen yararlıdırlar, mesela virüsün varlığı yersinia pestis bakterisi gibi bazı bakterilere karşı bağışıklığı arttırabilir.
Bazı virüsler hayat boyu kronik enfeksiyonlara neden olurlar, bu virüsler konağın savunma mekanizmalarına rağmen vücutta çoğaltmaya devam ederler. Buna en iyi örnek hepatit B ve hepatit C virüsleridir . Kronik olarak hasta insanlar taşıyıcı olarak adlandırılırlar ve enfeksiyöz virüsün rezervuarlarıdır. Taşıyıcıların oranının yüksek olduğu toplumlarda, hastalığın endemik olduğu söylenir.
Kanser
- Konu hakkında ayrıntılı bilgi için Kanser maddesine bakınız.
- Konu hakkında ayrıntılı bilgi için Onkovirüs maddesine bakınız.
Virüsler insan ve diğer türler için kanser nedenlerinden biridir. Viral kanserler enfekte kişilerin ya da hayvanların az bir kısmında meydana gelir. Kanser virüsleri DNA ve RNA virüslerini barındıran bir virüs gurubudur, tek tip bir "onkovirüs" yoktur,onkovirüs gurubunda birçok aileden etken vardır. Kanser gelişimini etkileyen çeşitli birçok faktör vardır konak bağışıklığı ve virüsün konakta mutasyon geçirmesi bunlardan ikisidir. Virüslerin bazı türleri ve bazı genotiplerinin insanlarda kanserlere neden olduğu kabul edilmektedir, bunlardan bazıları insan papilloma virüsü, hepatit B virüsü, hepatit C virüsü, Epstein–Barr virüs, Kaposi sarcoma-bağlantılı herpesvirüs ve İnsan T-lenfotropik virüs. İnsan kanserlerinde en çok rastlanan virüs ise polyomavirüstur (Merkel cell polyomavirüs) bu virüs Merkel hücre karsinoması adı verilen cilt kanserlerine neden olur. Hepatit virüsleri hepatosellüler karsinomlara yol açan kronik enfeksiyonlara neden olurlar.[77][78] İnsan T-lenfotropik virüsü tropikal spastik paraparezilere ve yetişkin T-hücresi lösemilerine yol açar.[79] İnsan papillomavirüsleri serviks, cilt, makat ve penis kanserlerine neden olurlar.[80] Merkel hücre polyomavirüsü, SV40 ve fare polyomavirüsleri yakın ilişkili virüslerdır ve 50 yıldan uzun bir süredir kanser virüslerinin hayvan modeli olarak kullanılırlar.
Sucul ekosistemlerde rol
Bir çay kaşığı deniz suyu yaklaşık bir milyon tane virüs içermektedir.[81] Bunların çoğu bakteriyofajlardır, tuzlu su ve tatlı su ekosistemlerinin düzenlenmesi için gereklidirlen ve bitki ve hayvanlar için zararsızdırlar.[82] Bunlar sucul mikrobiyal topluluklardaki bakterileri enfekte edip öldürürler ve deniz ortamında karbon geri dönüşümünün en önemli mekanizmasıdır. Ölü bakterilerden yayılan organik moleküller, genç alglerin ve bakterilerin gelişmesini sağlar. Viral aktivite biyolojik pompaya hizmet eder, bu süreç sayesinde karbon dünyadan çekilir.
Mikroorganizmalar deniz kütlesinin %90'ını oluşturmaktadırlar. Virüsler her gün bu yığının %20'sini öldürmektedirler ve okyanuslarda bakteriler ve arkelerden 15 kat daha fazladırlar. Virüsler zararlı alg yayılmasını engellemekten sorumlu ana maddelerdir.[83] Açık denizlerde ve okyanusun derinliklerine daha az konak organizma olduğu için doğu virüs sayısı da azalır.
Her organizma gibi, deniz memelileri de viral enfeksiyonlara karşı duyarlıdırlar. 1988 ve 2002'de, Avrupada binlerce sığ su foku phocine distemper virüs enfeksiyonu nedeniyle ölmüştür. Kalisivirüsler , herpesvirüsler , adenovirüsler ve parvovirüsler gibi diğer birçok virüs deniz memeli nüfusu arasında dolaşırlar.
Evrimdeki rolü
Virüsler farklı türler arasında gen transferi yapabilen ve genetik çeşitliliği arttıran önemli araçlardır.[7] Yeryüzündeki hayatın son evrimsel atasının olduğu zamanlarda ve bakteri, arke ve ökaryotların çeşitlenmesinden önce virüslerin erken evrimde önemli bir rol oynadığı düşünülmektedir. Virüsler hala yeryüzünde keşfedilmemiş genetik çeşitliliğin en büyük rezervuarlarından biridir.
Uygulamalar
Canlı bilimleri ve tıp

Virüsler, moleküler biyoloji ve hücre biyolojisi çalışmalarına önemlidir, hücrelerin fonksiyonlarını değiştirmek ve incelemek için kullanılabilen basit sistemlerdir.[84] Çalışmalarda virüslerin kullanımı hücre biyolojisi hakkında değerli bilgiler sağlamıştır. Virüsler genetik çalışmalarında çok kullanışlıdırlar ve moleküler genetiğin temel mekanizmalarını anlamamızda yardımcı olurlar. Örneğin, DNA replikasyonu, transkripsiyonu, RNA işlenmesi, translasyonu, protein taşınması ve immünoloji.
Genetikçiler hücre genlerini tanımlamak için virüsleri bir vektör gibi kullanırlar. Virüsler hücrede yabancı bir madde üretmek ya da hücre genomunun içine yerleştirilern yeni bir genin etkisini araştırmak için kullanışlıdır. Benzer bir şekilde, viroterapide bazı hastalıkları tedavisinde virüsler vektör gibi kullanılırlar. Kanser tedavisinde ve gen tedavisinde kullanımları ümit vericidir. Doğu Avrupalı bilim insanları bakteriyofajları bezen antibiyotiklerin alternatifi gibi kullanmışladır, antibiyotik direnci kazanmış yüksek patojen bakterileri öldürmek için bu yöntem düşünülmektedir. Virüslerin heterolog proteinlerinin ekspresyonu şu anda kullanılmakta olan antikorlar ve antijenler gibi çeşitli proteinlerin üretim işlemlerinin temelidir. Ön-klinik ve klinik çalışmalarda viral vektörler ve bir dizi farmasötik proteinler kullanılarak son zamanlarda endüstriyel işlemler geliştirilmiştir.
Viroterapi
Viroterapi hastalıkları tedavi etmek için genetik olarak modifiye edilmiş virüslerin kullanımını gerektirir.[85] Virüsler kanserli hücrelerde çoğalıp onları yok ederken sağlıklı hücrelere zarar vermeyecek şekilde modifiye edilmiştir. Örneğin Talimogene laherparepvec (T-VEC), sağlıklı hücrelerde replike olması için ihtiyaç duygugu gen silinip yerine bağışıklığı uyaran insan geni (GM-CSF) eklenmiş bir modifiye herpes simpleks virüstür. Bu virüs kanser hücrelerini enfekte ettiğinde onları parçalar ve GM-CDF geninin varlığı ile dentritik hücreleri vücudun çevre dokularından buraya toplar. Dentritik hücreler ölü kanser hücrelerini işler ve parçalarını bağışıklık sisteminin diğer hücrelerine sunar.[86] Klinik deneyleri başarı ile tamamlayan bu virüs 2015 yılının sonlarında bir cilt kanserinin tedavisi için onay beklemekteydi.[87] Kanser hücrelerini öldürmek için yeniden programlanan virslara onkolitik virüsler denir.
Malzeme bilimi ve nanoteknoloji
Nanoteknoloji araştırmalarına eğilimler, virüslerden çok yönlü faydalanılmasına kapı aralamaktadır. Bir Malzeme bilimci açısından, virüsler, organik nanopartiküller olarak kabul edilebilir. Yüzeyleri konak hücrelerinin engellerini geçmek için tasarlanmış özel araçlar taşır. Virüslerin büyüklükleri ve şekilleri, yüzeylerindeki doğal ve fonksiyonel gurupların sayısı tam olarak tanımlanmıştır. Virüsler genelde malzeme biliminde kullanılan iskeletler gibi kovalent bağla bağlanmış yüzey değişkenlerine sahiptirler. Canlı bilimlerinde çok güçlü teknikler geliştirilmiştir, nanomaddelere olan yaklaşımlar biyoloji ve tıbbın dışında da geniş bir uygulama yelpazesi açmakta ve mühendisliğin temeli haline gelmektedir.
Şekilleri, boyutları ve çok iyi tanımlanmış kimyasal yapıları nedeniyle virüsler nano materyalleri düzenlemek için şablon olarak kullanılmaktadır. Bunun son örneklerinden biri Washington, DC'de Naval Araştırma Laboratuvarında gerçekleştirilmiş ve DNA mikrodizi tabanlı sensörlerin sinyallerini yükseltmek için Cowpea mosaic virüsü (CPMV) partikülleri kullanılmıştır. Bu uygulamada, floresan yoğunluğunu azaltan ve floresan olmayan dimerlerin sinyal vermelerini önlemek için virüs partikülleri floresan boyalar kullanılarak ayrılmıştır.[88] CPMV'nin moleküler elektronikte kullanımı da vardır.[89]
Sentetik virüsler
Birçok virüsün sentetiği üretileblir ("sıfırdan") ve ilk sentetik virüs 2002 yılında üretilmiştir. Biraz yanlış anlaşılsa da sentezlenen virüs asıl virüs değildir, daha doğrusu DNA genomu (DNA virüsler ) ya da genomun cDNA (RNA virüslerinde) kopyasıdır . Birçok DNA ve RNA (önceden enzimatik olarak cDNA'ya dönüştürülürse) virüs ailesinin çıplak genomu konak hücreye girdiğinde enfeksiyon oluşturabilir yani yeni virüsler üretmek için gerekli tüm bilgileri içerir. Bu teknoloji yeni aşı stratejilerini araştırmak için kullanılmaktadır. Virüs sentez yeteneğinin geniş kapsamlı sonuçları vardır, Virüs genom bilgilerini kendi genom dizilerinde barındıran ve bunlara müsamaha gösteren hücrelerin varlığı, virüs neslinin tüketilemeyeceğini düşündürmektedir. Mart 2014 itibariyle, 3843 farklı virüsün genom dizileri Ulusal Sağlık Enstitüsünün halka açık çevrim içi veri tabanında yer almaktadır.[90]
Silah olarak kullanımı
- Konu hakkında ayrıntılı bilgi için Biyolojik savaş maddesine bakınız.
Toplumlarda yıkıcı salgınlara neden olan virüslerin biyolojik silah olarak kullanılabileceği endişesine yol açmıştır. 1918 grip virüsünün laboratuvar ortamında başarılı bir şekilde tekrardan üretilmesi endişelerin artmasına yol açtı. Eradike edilmeden önce çiçek hastalığı toplumları defalarca harap etti. Çiçek virüsünü stoklarında tutmak için yetkili olan dünyada sadece iki merkez vardır: Birisi Rusyadaki Vector Institute ve diğeri de ABD'deki CDC'dir. Virüslerin silah olarak kullanılabileceklerine dair endişeler asılsız olmayabilir. Ciddi yan etkilere sahip çiçek aşısı artık hiçbir ülkede rutin olarak kullanılmamaktadır. Böylece, modern insan toplumlarında çiçek virüsüne karşı direnç neredeyse yok olmuştur ve virüse karşı savunmasızdırlar.
Ayrıca bakınız
- Konağı ökaryot olan virüslerin listesi
- Konağı bakteri olan virüslerin listesi
- Non-cellular life
- Cross-species transmission
- Viral metagenomics
- Viroplasm
- Zoonoz hastalıklar
Dış bağlantılar
| Daha fazla bilgi için Vikipedi'nin kardeş projelerinde ara | |
|---|---|
| |
bu maddeyi Vikisözlük'te ara |
| |
bu maddeyi Vikikitap'ta ara |
| |
bu maddeyi Vikisöz'de ara |
| |
bu maddeyi Vikikaynak'ta ara |
| |
bu maddeyi Commons'da ara |
| |
bu maddeyi Vikihaber'de ara |
| |
bu maddeyi Vikiversite'de ara |
- ViralZone Tüm virüs ailelerini kapsayan, genel moleküler ve epidemiyolojik bilgiler veren bir İsviçre Biyoinformatik Enstitüsü araştırması.
- David Baltimore online Seminar: "Introduction to Viruses and HIV"
- Ari Helenius online seminar: "Virus entry"
- "A Gazillion Tiny Avatars", Olivia Judson'ın virüsler hakkındaki makalesi, NY Times, 15 Aralık 2009
- Khan Academy, video lecture
- Viruses – açık erişimli bir dergi.
- 3D virus structures in EM Data Bank (EMDB)
Kaynakça
- 1 2 Koonin EV, Senkevich TG, Dolja VV.
- 1 2 3 Dimmock p. 4
- 1 2 3 Dimmock p. 49
- 1 2 Breitbart M, Rohwer F. Here a virus, there a virus, everywhere the same virus?
- 1 2 Lawrence CM, Menon S, Eilers BJ, et al.
- ↑ Edwards RA, Rohwer F. Viral metagenomics.
- 1 2 Canchaya C, Fournous G, Chibani-Chennoufi S, Dillmann ML, Brüssow H. Phage as agents of lateral gene transfer.
- 1 2 Rybicki, EP.
- ↑ Shors pp. 49–50
- ↑ "virus, n."
- ↑ Harper D. The Online Etymology Dictionary. virulent; 2011 [Retrieved 2014-12-19].
- ↑ e.g.
- ↑ e.g.
- ↑ William T. Stearn: Botanical Latin.
- ↑ Pons: virus
- ↑ Harper D. The Online Etymology Dictionary. viral; 2011 [Retrieved 2014-12-19].
- ↑ Bordenave G. Louis Pasteur (1822–1895).
- ↑ Shors pp. 76–77
- ↑ D'Herelle F. On an invisible microbe antagonistic toward dysenteric bacilli: brief note by Mr. F. D'Herelle, presented by Mr. Roux.
- ↑ Steinhardt E, Israeli C, Lambert R.A..
- ↑ Collier p. 4
- ↑ Goodpasture EW, Woodruff AM, Buddingh GJ.
- ↑ Rosen, FS.
- ↑ From Nobel Lectures, Physics 1981–1990, (1993) Editor-in-Charge Tore Frängsmyr, Editor Gösta Ekspång, World Scientific Publishing Co., Singapore.
- ↑ Stanley WM, Loring HS.
- ↑ Stanley WM, Lauffer MA.
- ↑ François Jacob, Qu’est-ce que la vie ? in La Vie, Université de tous les savoirs, Editions Odile Jacob, 2002.
- ↑ Raoult D, Audic S, Robert C, Abergel C, Renesto P, Ogata H, La Scola B, Suzan M, Claverie JM. The 1.2-megabase genome sequence of Mimivirus. Science. 2004 Nov 19;306(5700):1344-50.
- ↑ Collier pp. 11–21
- ↑ The origin and behavior of mutable loci in maize.
- ↑ Collier pp. 11–12
- ↑ Dimmock p. 55
- ↑ Shors 551–3
- ↑ Dimmock p. 55–7
- ↑ Delwart EL.
- ↑ Virus Taxonomy 2013.
- ↑ ICTV Master Species List 2013 v2
- ↑ Collier pp. 40, 42
- ↑ Casens, S. Desk Encyclopedia of General Virology.
- ↑ Collier pp. 42–43
- ↑ Pennisi E (2011).
- ↑ Philippe N, Legendre M, Doutre G, Couté Y, Poirot O, Lescot M, Arslan D, Seltzer V, Bertaux L, Bruley C, Garin J, Claverie JM, Abergel C (2013).
- ↑ Pressing J, Reanney DC.
- ↑ Rossmann MG, Mesyanzhinov VV, Arisaka F, Leiman PG.
- ↑ Dimmock p. 70
- ↑ Boevink P, Oparka KJ.
- ↑ Dimmock p. 71
- ↑ Dimmock, Chapter 15, Mechanisms in virus latentcy, pp.243–259
- ↑ Dimmock 185–187
- ↑ Shors p. 54; Collier p. 78
- ↑ Collier p. 79
- ↑ Collier pp. 115–146
- ↑ Shors p. 353
- ↑ Dimmock p. 272
- ↑ Collier p. 115
- ↑ Shors pp. 199, 209
- ↑ Shors p. 19
- ↑ Shors p. 126
- ↑ Shors pp. 192–193
- ↑ Ranlet P. The British, the Indians, and smallpox: what actually happened at Fort Pitt in 1763?. Pa Hist. 2000 [Retrieved 16 September 2008];67(3):427–41. PMID 17216901.
- ↑ Collier pp. 409–415
- ↑ Chen YP, Zhao Y, Hammond J, Hsu H, Evans JD, Feldlaufer MF.
- ↑ Shors p. 584
- ↑ Shors pp. 562–587
- ↑ Dinesh-Kumar SP, Tham Wai-Hong, Baker BJ.
- ↑ Shors pp. 573–576
- ↑ Soosaar JL, Burch-Smith TM, Dinesh-Kumar SP.
- ↑ Bergh O, Børsheim KY, Bratbak G, Heldal M. High abundance of viruses found in aquatic environments.
- ↑ Shors pp. 595–97
- ↑ Bickle TA, Krüger DH.
- ↑ Barrangou R, Fremaux C, Deveau H, et al.
- ↑ Brouns SJ, Jore MM, Lundgren M, et al.
- ↑ Prangishvili D, Garrett RA.
- ↑ Mojica FJ, Díez-Villaseñor C, García-Martínez J, Soria E. Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements.
- ↑ Makarova KS, Grishin NV, Shabalina SA, Wolf YI, Koonin EV.
- ↑ Barton ES, White DW, Cathelyn JS, et al.
- ↑ Hu J, Ludgate L. HIV-HBV and HIV-HCV coinfection and liver cancer development.
- ↑ Bellon M, Nicot C. Telomerase: a crucial player in HTLV-I-induced human T-cell leukemia.
- ↑ Schiffman M, Castle PE, Jeronimo J, Rodriguez AC, Wacholder S. Human papillomavirus and cervical cancer.
- ↑ Klein E, Kis LL, Klein G. Epstein-Barr virus infection in humans: from harmless to life endangering virus-lymphocyte interactions.
- ↑ Shors p. 5
- ↑ Shors p. 593
- ↑ Hall, A. J., Jepson, P. D., Goodman, S. J. & Harkonen, T. "Phocine distemper virus in the North and European Seas — data and models, nature and nurture".
- ↑ Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James.
- ↑ Karimkhani, C; Gonzalez, R; Dellavalle, R. P. (2014).
- ↑ "Injectable T-VEC Offers Hope to Melanoma Patients", Medscape, May 28, 2015, Retrieved 20 May 2015
- ↑ Burke, J; Nieva, J; Borad, M. J.; Breitbach, C. J. (2015).
- ↑ Blum AS, Soto CM, Wilson CD et al.
- ↑ Cello J, Paul AV, Wimmer E. Chemical synthesis of poliovirus cDNA: generation of infectious virus in the absence of natural template.
- ↑ Shors p. 331
| ||||||||||||||||||||
|